Was sind eigentlich Zeolithe? Wie unterscheiden sich die verschiedenen Arten? Wie geht Adsorption vor sich? Wie verhalten sich Zeolithe in technischen Abluftreinigungsanlagen? Zu diesen Fragen und noch einigen mehr in zwei mal 45 Minuten eine Antwort zu geben ist natürlich nicht möglich. Ich habe es auf den 1. Heidelberger Ablufttagen trotzdem versucht. Das Ergebnis - zwei Vortragsmanuskripte mit Folien - biete ich hier zum Download an. Im ersten Vortrag taucht ein Video auf, welches die Porenstruktur von Faujasit - dem Strukturtyp der Zeolithe X und Y - demonstriert. Ich habe es mit dem 3D-Builder der Strukturdatenbank der IZA erstellt. Was hier zu sehen ist, wird im ersten Manuskript erklärt und folgt noch einmal in aller Kürze: Im Stäbchenmodell erkennt man den Aufbau … [Weiterlesen...]
Über Adsorptionsisothermen, Teil II
Wie schon im Teil I dieses Beitrages erwähnt, werden in der Praxis kaum andere Adsorptionsisothermen verwendet als die von Langmuir, Freundlich und Geradengleichungen (manchmal fälschlich als "Henry"-Isotherme bezeichnet). Andere Isothermen, denen man in der Praxis noch begegnet, sind die BET-Isotherme, die vor allem zur Bestimmung von Adsorbensoberflächen benutzt wird die Dubinin-Radushkevich-Isotherme oder eine ihrer zahlreichen Abwandlungen, die vor allem die energetische Verteilung der Adsorptionsplätze gut abbilden kann. … [Weiterlesen...]
Über Adsorptionsisothermen, Teil I
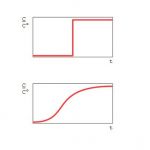
Was ist eine Adsorptionsisotherme? Als Adsorptionsisotherme bezeichnet man die Beziehung zwischen der freien Adsorptiv-konzentration (als mg/m³ ausgedrückt oder als Partialdruck in Pa) und der im Gleichgewichtszustand gebundenen Menge an Adsorpt, gemessen bei konstanter Temperatur: θA = f(pA) oder auch mit dem Partialdruck als Anteil des Sättigungsdampfdruckes ausgedrückt: θA = f(pA/p°A) Ein Beispiel zeigt die Abbildung oben, mit der Besonderheit, dass die Adsorption einen Sättigungsbereich hat, d. h. eine Adsorbatmenge pro Gewichtsanteil Adsorbens, die nicht überschritten werden kann. Dies ist allerdings nicht für jedes Adsorbens-Adsorptiv-Paar der Fall. Zweck einer Adsorptionsisotherme Eine Adsorptionsisotherme kann mit zwei verschiedenen Absichten erstellt worden … [Weiterlesen...]
Schüttdichte und Druckverlust, Teil I
Ursprünglich sollte dieser Artikel heißen "Über die Randgängigkeit von Schüttungen". Ich wollte darin der Frage nachgehen, ob die oft zitierte Behauptung, ein Schüttbett müsse für gleichmäßige Durchströmung wenigstens zehn Partikeldurchmesser als Durchmesser haben, irgendeine Grundlage hat. Diese Grundlage gibt es tatsächlich, aber die Frage ist nur eine Variation der größeren Frage nach der Schüttdichte, und somit dem Druckverlust eines Schüttbettes. … [Weiterlesen...]
Hysterese bei der Adsorption und Desorption, Teil II
Wie schon im Teil I dieses Beitrags erläutert, spricht man von Hysterese im Zusammenhang mit Adsorption, wenn die Isotherme des Adsorptionsvorgangs nicht mit derjenigen des Desorptionsvorganges zusammenfällt. Dies kann verschiedene Formen annehmen. Die IUPAC definiert zur Zeit sechs verschiedene Hysteresetypen (Abb. 1, Quelle: [1]) Was sagen die verschiedenen Formen der Hystereskurven über den dahinterliegenden Mechanismus aus? Und was kann man unternehmen, wenn ein solcher Effekt in der Praxis stört? … [Weiterlesen...]
Überschwingverhalten in Adsorbern („overshoot“ oder „roll-up“-Phänomen)
Das Diagramm zeigt die Durchbruchkurven von verschiedenen Verunreinigungen in einem Modell-Dieselkraftstoff, welche flüssig über ein Adsorbens gegeben wurden. Naphthalin und 1-Methylnaphthalin (1-MN) erscheinen ziemlich bald am Säulenausgang, und zwar im angereicherten Zustand - 20% bzw. 40% höher konzentriert als sie ursprünglich aufgegeben wurden. Dieses Überschwingverhalten wird in der Literatur gewöhnlich als "roll-up phenomenon" bezeichnet. Im flüssigen Zustand ist es gewöhnlich schärfer ausgeprägt als in der Gasphase und wird z. B. in der Chromatographie zur Anreicherung von Wirkstoffen verwendet. Was treibt diesen Vorgang an? … [Weiterlesen...]
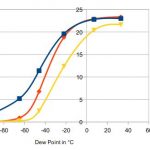
Hygroskopie, oder Wasserdampfsorption
Hygroskopie (manchmal fälschlich als "Hydroskopie" buchstabiert) bezeichnet die Neigung von Feststoffen oder Flüssigkeiten, Wasserdampf aus der Atmosphäre anzuziehen. Diese Eigenschaft kann nicht direkt mit einer einzelnen Zahl - einem "Hygroskopizitätsindex" - charakterisiert werden, sondern man benötigt mindestens eine Adsorptionsisotherme dazu. Stoffe können auf ganz unterschiedliche Weise hygroskopisch sein: Manche, wie Zeolithe, lagern eine definierte Menge Wasser ein und bleiben ansonsten äußerlich unverändert. Andere, wie Calciumchlorid CaCl2, nehmen so lange Wasser auf, bis sie sich im aufgenommenen Wasser auflösen, wie der folgende Zeitraffer zeigt: Deliquescence of Calcium Chloride von boborama, gesehen auf Vimeo. … [Weiterlesen...]
Landunter: Zeolithe im Unterwasserbetrieb für verschiedene Aufgaben
Hauptanwendung: Aquakultur Neben den zahlreichen Anwendungen in der Gasphase werden Zeolithe auch "versenkt" - also komplett unter Wasser angewendet. Bei Naturzeolithen ist das sogar die häufigere Anwendungsart, weil diese Materialien neben der Verwendung als Betonzuschlagstoff am häufigsten zur Wasserfilterung eingesetzt werden. Insbesondere die durch den wachsenden Fischverbrauch der Welt zunehmende Aquakultur ist ein großes Anwendungsgebiet. … [Weiterlesen...]
Chemische Literatur für Praktiker Teil 2 – Adsorptionsisothermen aus wissenschaftlichen Aufsätzen verwerten
Beispiel 2: Isothermen konstruieren, wo keine sind Das folgende Beispiel stellt eine kinetische Untersuchung dar, es wurde PEG (Polyethylenglykol mit Molekulargewichten von 5.000 - 7.000) aus wässrigen Lösungen auf DAY adsorbiert (ein mittlerweile vom Markt verschwundener, aber vielfach kopierter hydrophober Faujasit, 13Y) [1]. Der DAY war vorher zermahlen, gesiebt, gewaschen und getrocknet worden. … [Weiterlesen...]
Chemisorption und Physisorption
Wenn sich ein Molekül einer Oberfläche nähert - sei es ein Wassermolekül einem Trockenmittel, oder ein Stickoxidmolekül einer Katalysatoroberfläche - kann es dort chemisorbiert oder physisorbiert werden. Worin besteht der Unterschied, und wie kann man ihn feststellen, und warum ist die Unterscheidung wichtig? … [Weiterlesen...]