Hygroskopie (manchmal fälschlich als „Hydroskopie“ buchstabiert) bezeichnet die Neigung von Feststoffen oder Flüssigkeiten, Wasserdampf aus der Atmosphäre anzuziehen. Diese Eigenschaft kann nicht direkt mit einer einzelnen Zahl – einem „Hygroskopizitätsindex“ – charakterisiert werden, sondern man benötigt mindestens eine Adsorptionsisotherme dazu.
Stoffe können auf ganz unterschiedliche Weise hygroskopisch sein: Manche, wie Zeolithe, lagern eine definierte Menge Wasser ein und bleiben ansonsten äußerlich unverändert. Andere, wie Calciumchlorid CaCl2, nehmen so lange Wasser auf, bis sie sich im aufgenommenen Wasser auflösen, wie der folgende Zeitraffer zeigt: Deliquescence of Calcium Chloride von boborama, gesehen auf Vimeo.
Definitionen
Der Transport-Informations-Service, eine Website vom Gesamtverband der Deutschen Versicherungswirtschaft e.V., erklärt die Grundlagen so, wie es für Spediteure und Betreiber von Lagerhäusern am ehesten von Interesse wäre. Es wird sehr anschaulich erklärt, wie eine Adsorptionsisotherme zu lesen ist, wenn man etwas über den Einfluss der Lagerbedingungen auf die Produktqualität erfahren will.
Materialvergleich
-
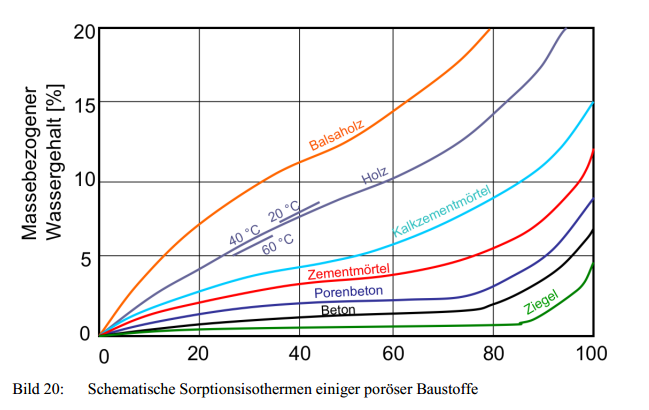
Quelle: http://www.unibw.de/werkstoffe/lehre/skripte/stoffkennwerte.pdf, ein Vorlesungsskript von Prof. K.-Ch. Thienel für die Universität der Bundeswehr München
Beim Vergleich der Datenpunkte für eine mittlere relative Luftfeuchte – sagen wir, 40% r. H. – kann man z. B. ablesen, dass Beton etwa einen doppelt so hohen Wassergehalt hat wie Ziegel.
- Steigt die Luftfeuchte von 40 auf 60% r. H., so nehmen Ziegel fast gar kein Wasser auf, Holz dagegen ca. 2 Gewichtsprozent. Dies ist der vielbeschworene Effekt auf das Raumklima organischer Baustoffe wie Holz, aber auch Wolle und anderer Materialien: Sie haben fast immer steile Adsorptionsisothermen, nehmen also Wasser auf, wenn die Feuchte steigt, und geben es wieder ab, wenn die Luft trockener ist, tragen also dazu bei, die Luftfeuchte nahe einem mittleren Wohlfühlbereich zu halten. Der Effekt ist selbstverständlich nur dann merklich, wenn
(a) die Masse der Baustoffe und das Raumvolumen zueinander passen – ein paar kleine Wollteppiche in einem großen Saal haben keine fühlbare Wirkung – und
(b) der Luftwechsel entsprechend gering ist. Ein Rechenbeispiel dazu: 1 m² Fichten-Bretter, 20 mm, haben ein Volumen von 20 l und eine Masse von 9,4 kg. Beim Übergang von 40 zu 60% relativer Feuchte nimmt dieser Quadratmeter Täfelung maximal 190 g Wasser auf: Das ist das Wasser, was beim genannten Übergang aus ca. 50 m³ Luft aufzunehmen ist, betrifft aber die vollständige Dicke der Bretter. Das Wasser braucht einige Stunden, um die Bretter vollständig zu penetrieren.
Mechanismen der Hygroskopie
Salze
Hygroskopische Salze können Wasser bis zu einer bestimmten Stufe aufnehmen und dabei kristallin bleiben. Eine Tabelle mit ein paar Beispielen bietet Chemgapedia. Dabei ändert sich die Kristallstruktur der Salze, was oft mit bloßem Auge sichtbar ist. So ist etwa das Binden von Gips-Halbhydrat (CaSO4 . 0,5 H2O) zu Gips (CaSO4 . 2 H2O) dadurch verursacht, dass die sich neu bildenden Kristalle zu einer dichten Filzstruktur zusammenwachsen. Die Triebkraft des Vorgangs ist eine Wärmetönung bei der Aufnahme von Wasser in das Kristallgerüst. [1]
Bei manchen Salzen endet die Wasseraufnahme damit, manche sind aber auch in der Hydratform noch so hygroskopisch, dass sie, ausreichend Feuchte vorausgesetzt, weiter Wasser aufnehmen und an der Luft zerfließen.
Manche Salze verbacken beim Lagern. Das liegt daran, dass Tröpfchen konzentrierter Salzlösung an den Brücken zwischen zwei Kristallen hängen und später wieder austrocknen, wenn die Luftfeuchte sinkt oder die Temperatur steigt. An der Stelle hat aber bereits Kristallwachstum eine feste Verbindung zwischen zwei Kristallen entstehen lassen. [2]
Organische Verbindungen
Etliche organische, nicht-kristalline Verbindungen sind ebenfalls hygroskopisch. Beispiele sind Nylon-6 (-[CO-NH-CH2-CH2-CH2-CH2]-) oder getrocknete Eiweiße, wie Rinder-Serumalbumin. [3] Hier ist es hauptsächlich die Energie, die bei der Bildung von Wasserstoffbrückenbindungen frei wird, die die Einlagerung von Wasser vorantreibt, welche letztlich zur Quellung und zur Änderung der mechanischen Eigenschaften der Feststoffe führt.
Physisorption an feste Oberflächen
Die eben beschriebenen Mechanismen – Hydratbildung, Bildung von Wasserstoffbrückenbindungen oder Ausbildung von Hydrathüllen um Kationen werden oft als „chemische Hygroskopie“ bezeichnet, weil sich die chemische Struktur des wasseraufnehmenden Stoffes dabei ändert. Auch bei der Physisorption an feste Oberflächen werden Bindungen ausgebildet, diese sind aber nur schwach.
Auf Metalloberflächen bildet sich eine geordnete monomolekulare Haut aus Wasser. Es gibt einige Untersuchungen darüber, wie diese Wasserhaut auf definierten Einkristalloberflächen aussieht, z. B. [4]. (Artikelvorschau mit Bildern)
Wasser auf Glasoberflächen ist zunächst nur physisorbiert, entweder an freien Silanolgruppen, an Sauerstoffbrücken oder auch an unabgesättigtem Silizium. Mit der Zeit – über Wochen und Monate – verbindet sich das Wasser jedoch chemisch mit dem Glas, es bildet sich eine Diffusionsschicht in die Tiefen des Glases aus. Sehr anschaulich ist das in einem Infoletter der Firma Schott erklärt.
In Zeolithen sind die Verhältnisse nochmals komplizierter, weil es dort verschiedene Stellen gibt, an denen das Wasser sitzen kann. Diese Stellen sind energetisch nicht gleich, und wenn ein trockener Zeolith mit Wasserdampf in Berührung kommt, werden zunächst die Adsorptionsplätze besetzt, die die größte Energiemenge freisetzen. Dies sind bei hydrophilen Zeolithen die freien Kationen, etwa Natrium beim Zeolithen 4A [5]; diese ordnen sich beim Hydratisieren und Trocknen des Zeolithen um [6].
Sind diese stark adsorbierenden Plätze belegt, bleiben nur noch die schwachen Bindungsstellen an freien Silanolgruppen und anderen Gitterdefekten.Wird noch mehr Wasser in den Zeolithen eingebracht, so dass beinahe der Sättigungsdampfdruck erreicht ist, beginnt das Wasser sich innerhalb der Poren zu Nanotröpfchen zusammenzuballen. Dies ist zumindest das Ergebnis von Simulationen [7]. Bei kommerziellen, gebundenen Zeolithen wird allerdings schon vor diesem Punkt Wasser im Transportporensystem des Binders kondensieren, so dass Nanotröpfchenbildung in der Praxis wohl keine Rolle spielen wird.
Der Vorgang ier Nanotröpfchenbildung findet ab ca. 95% relativer Feuchte auch in hydrophoben Zeolithen statt, die eigentlich kein Wasser in merklichen Mengen adsorbieren. Da die Porenoberfläche hydrophiler Zeolithe deutlich polarer ist als die hydrophober Zeolithe, überbrücken die Nanotröpfchen in hydrophilen Zeolithen den Spalt zur Porenwandung mit zahlreichen Wasserstoffbrückenbindungen, während in hydrophoben Zeolithen das Nanotröpfchen sich in sich selbst abschließt und versucht, sein Netz aus Wasserstoffbrückenbindungen in sich selbst abzuschließen.
Die folgende Abbildung zeigt die Ausbildung von Wasser-Nanotröpfchen im Porensystem eines Zeolithen (Quelle: [7])
[1] Da die Entropie sinkt, wenn Wasser aus der Gas- in eine kondensierte Phase übergeht, muss die die Hydratisierung exotherm sein, da sonst insgesamt die freie Energie des Vorgangs nicht negativ sein kann.
[2] Langlet, M., Nadaud, F., Benali, M., Pezron, I., Saleh, K., Guigon, P., & Metlas-Komunjer, L. (2011). „Kinetics of dissolution and recrystallization of sodium chloride at controlled relative humidity.“ KONA Powder and Particle Journal, 29, 168–179.
[3] Grdadolnik, J., & Maréchal, Y. (2001). „Bovine serum albumin observed by infrared spectrometry. II. Hydration mechanisms and interaction configurations of embedded H(2)O molecules.“ Biopolymers, 62(1), 54–67. http://doi.org/10.1002/1097-0282(2001)62:1<54::AID-BIP70>3.0.CO;2-4
[4] „A molecular perspective of water at metal interfaces.“ Javier Carrasco, Andrew Hodgson & Angelos Michaelides. Nature Materials 11, 667–674 (2012). doi:10.1038/nmat3354
[5] „Adsorption of water on zeolites of different types.“ B. Hunger, S. Matysik, M. Heuchel, E. Geidel, H. Toufar. Journal of thermal analysis, July 1997, Volume 49, Issue 1, pp 553-565
[6] „Water adsorption in hydrophilic zeolites: experiment and simulation.“ Juan Manuel Castillo, Juaquin Silvestre-Albero, Francisco Rodriguez-Reinoso, Thijs J. H. Vlugtc and Sofia Calero. Phys. Chem. Chem. Phys., 2013,15, 17374-17382 DOI: 10.1039/C3CP52910J
[7] Coudert, F.-X., Cailliez, F., Vuilleumier, R., Fuchs, A. H., & Boutin, A. (2009). „Water nanodroplets confined in zeolite pores.“ Faraday Discuss., 141, 377–398. http://doi.org/10.1039/B804992K
![Ausbildung von Nanotröpfchen in Zeolithporen. Quelle: [7]](http://www.arnold-chemie.de/wp2016/wp-content/uploads/2016/02/water-nanodroplets-zeolite-pores.gif)