Inhalt
Anhand einiger Beispiele aus der Literatur möchte ich zeigen, wie stark unterschiedlich die Desorption ablaufen kann. Meist ist es ein einzelner Faktor, der das Geschehen dominiert, etwa Coadsorptionseffekte bzw. Verdrängungsdesorption (Beispiel 2), die stark verlangsamte Diffusion (Beispiel 1) oder die Instabilität des Adsorbates (Beispiel 6). Generell ist zu sehen, dass – unabhängig davon, wo die Gleichgewichtslage ist – die Desorption immer um eine bis mehrere Größenordnungen langsamer abläuft als die Adsorption.
- n-Octan und n-Nonan auf Aktivkohle
- Benzol und Tetrachlorkohlenstoff auf Aktivkohle
- Dichlormethan auf Aktivkohle
- Aceton und Toluol auf Zeolith Y
- Toluol auf Aktivkohle und auf Zeolith Y
- Es desorbiert nicht, es verbrennt…
1. n-Octan und n-Nonan auf Aktivkohle
Literatur: Fletcher, A. J. & Thomas, K. M. „Adsorption and Desorption Kinetics of n-Octane and n-Nonane Vapors on Activated Carbon.“ Langmuir 15, 6908–6914 (1999).
Im ersten Beispiel werden die Geschwindigkeiten der Ad- und Desorption von Kohlenwasserstoffdämpfen auf einer einfachen Aktivkohle miteinander verglichen. Ein solcher Filter könnte zum Beispiel in der Zuleitung eines Kraftstofftanks eingebaut sein, um Emissionen aus dem geparkten Fahrzeug zu verhindern.
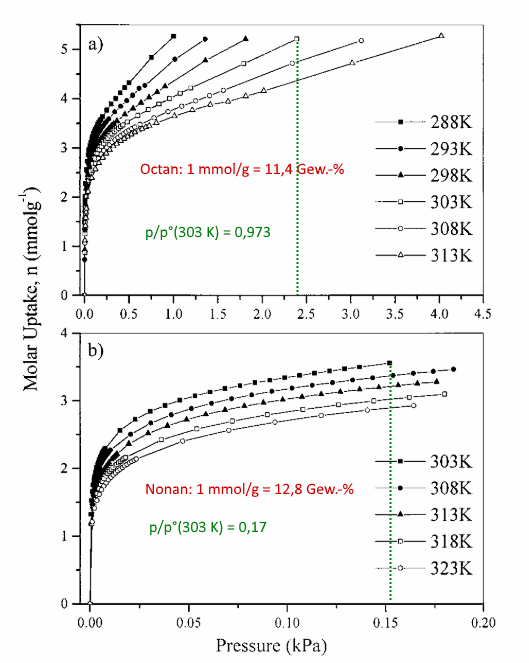
Diese Arbeit enthält einige unübliche Darstellungsformen, weswegen hier nur die direkten Messergebnisse der Desorption gezeigt werden sollen.
Was sind eigentlich die Geschwindigkeitskonstanten der Adsorption und Desorption? Es sind die Konstanten aus dem Geschwindigkeitsgesetz:
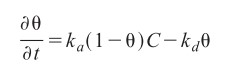
Hierbei bedeuten:
- θ = q/q0, Grad der Bedeckung der Kohlenstoffoberfläche
- t = Zeit
- C = Konzentration in der Gasphase
- ka und kd sind Konstanten, die ihrerseits von den Bedingungen Temperatur, Medien und Beladung abhängen.
Im Gleichgewichtszustand wird δθ/δt = 0, es findet keine Änderung der Beladung statt. Somit wird
ka (1 – θ)C = kdθ
Um das Gleichgewicht Richtung Desorption zu verschieben, muss also C möglichst klein werden. Das erreicht man durch Spülung mit Reingas. Damit der Vorgang schneller abgeschlossen ist, versucht man nun auch noch kd zu erhöhen, meistens durch eine Temperaturerhöhung (siehe das nächste Beispiel).
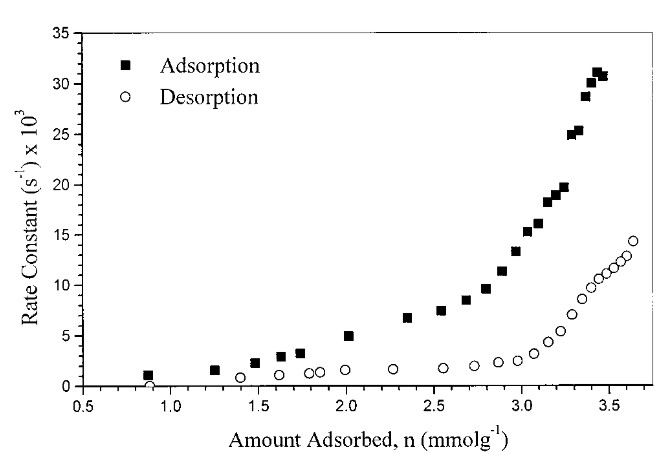
Die Geschwindigkeitskonstante der Adsorption ist bei gleicher Beladung um ein Vielfaches höher. Außerdem fällt auf, dass mit steigender Beladung beide Geschwindigkeitskonstanten steigen. Dies hängt mit einer Änderung der Adsorptions- und Diffusionsverhältnisse zusammen.
2. Benzol und Tetrachlorkohlenstoff auf Aktivkohle
Literatur: Chuang, C. L., Chiang, P. C., Chang, E. E. & Huang, C. P. „Adsorption – Desorption Rate of Nonpolar Volatile Organic Compounds onto Activated Carbon Exemplified by C6H6 and CCl4.“ Pract. Period. HAZARDOUS, TOXIC, Radioact. WASTE Manag. 148–155 (2003).
In dieser Arbeit wurde die Kinetik und die Gleichgewichtseinstellung von Tetrachlorkohlenstoff und Benzol auf Aktivkohle untersucht. Das Gleich-gewicht stellt sich erwartungsgemäß umso schneller ein, je höher die Temperatur ist. Das liegt an der beschleunigten Diffusion und daran, dass ein höherer Anteil der Moleküle die notwendige Aktivierungsenergie hat.
Da bei den Adsorptionsdaten die Angaben von Mol und Gramm gemischt verwendet werden, ist hier mein eigener Plot der Adsorptionsdaten.
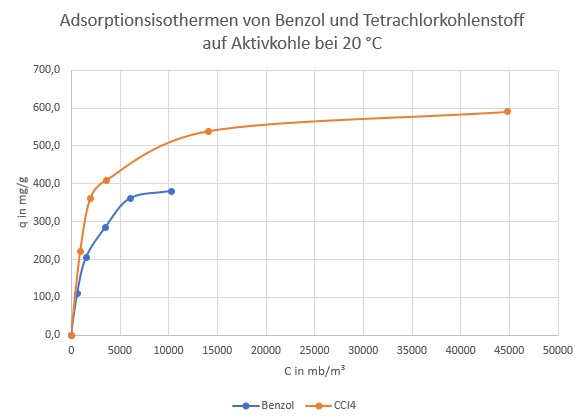
20 °C. Die Aktivkohle wurde zerkleinert und unter Stickstoff bei erhöhter Temperatur vordesorbiert.
Die folgende Originalabbildung zeigt den Zusammenhang zwischen der Temperatur und der Geschwindigkeitskonstante. Die Auftragung von ln(k) gegen 1/T wurde gewählt, damit das Ergebnis linear wird.
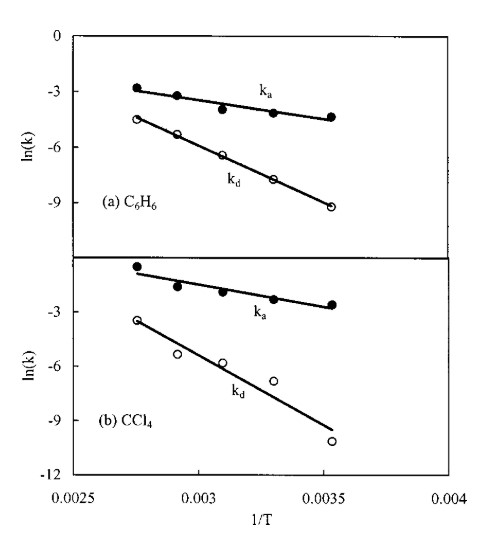
Der Anschaulichkeit halber könnte man zwar die nicht nicht logarith-mierten Werte gegen die Temperatur auftragen, aber das ist sinnlos: Der direkte Vergleich der Konstanten bedeutet zunächst einmal gar nichts, da sie unterschiedliche Einheiten haben. Die Einheit der Geschwindigkeits-konstante im Adsorptionsterm lautet m³/(s*mol), im Desorptionsterm 1/s [1].
In der folgenden Abbildung habe ich die Geschwindigkeit, mit der die Beladung sich ändert, aufgetragen. Die Bedingungen sind zunächst die, die man bei einer Desorption erwarten würde, nämlich eine Beladung der Aktivkohle von 90% der Maximalbeladung und eine verdünnte (aber nicht vollständig benzolfreie) Gasphase.
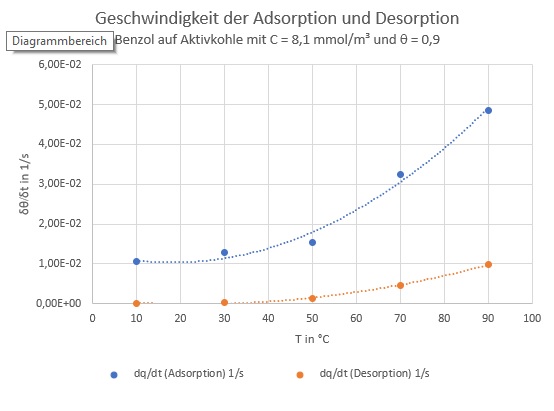
Die Geschwindigkeit der Adsorption bleibt immer höher, auch bei höheren Temperaturen. Dies ist aber die Geschwindigkeit und darf nicht mit der Gleichgewichtslage verwechselt werden, die den Zustand beschreibt, auf den das System sich einpendelt.
Das gleiche System „Benzol auf Aktivkohle“ noch einmal, diesmal mit wenig beladener Aktivkohle (10% der Maximalkapazität) und bei höher konzent-riertem Rohgas (3,9 g/m³): Die Geschwindigkeit der Desorption ist jetzt nicht eine, sondern drei bis vier Größenordnungen geringer als die der Adsorption.
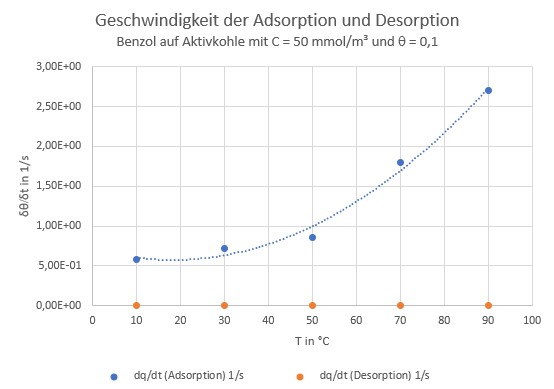
[1] In der Literatur steht zwar L/s, das ist aber eindeutig falsch. In fast jeder wissenschaft-lichen Publikation tun sich Fehler auf, wenn man erst einmal anfängt, mit den Zahlen wirklich zu arbeiten – Fehler, die beim peer review-Prozess einfach durchrutschen (garantiert auch mir…)
3. Dichlormethan auf Aktivkohle
Literatur: Lemus, J. et al. „Removal of chlorinated organic volatile compounds by gas phase adsorption with activated carbon.“ Chem. Eng. J. 211, 246–254 (2012).
In dieser Studie wurden verschiedene C1-Halogenkohlenwasserstoffe auf ihr Ad- und Desorptionsverhalten auf einer Aktivkohle von Merck untersucht. Das folgende Beispiel zeigt die Durchbruchkurven und anschließenden Desorptionskurven von Dichlormethan (DCM). Die Adsorption fand bei 1.000 ppmv DCM in Stickstoff statt (entspricht 3,5 g/m³), die Desorption mit reinem Stickstoff, die Temperatur war 35 °C.
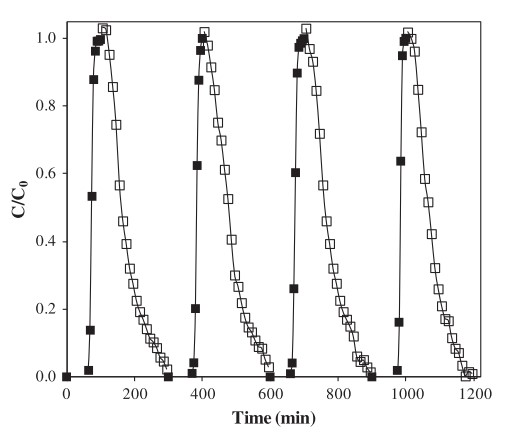
Die Desorption braucht in diesem Beispiel etwa vier Mal so lange wie die Adsorption. Dass es verhältnismäßig schnell geht, liegt an der hohen Flüchtigkeit und geringen Adsorptionsenthalpie von DCM, was auch die Aktivierungsenergie für die Desorption klein werden lässt.
4. Aceton und Toluol auf Zeolith Y
Literatur: Lee, D.-G., Kim, J.-H. & Lee, C.-H. „Adsorption and thermal regeneration of acetone and toluene vapors in dealuminated Y-zeolite bed.“ Sep. Purif. Technol. 77, 312–324 (2011).
Diese Arbeit zeigt die Unterschiede im Verhalten zweier Adsorptive, die auf Zeolith Y unterschiedliche Isothermen haben: Zeolith hat eine Typ-I-Isotherme, bei der die Adsorption schon bei geringen Konzentrationen hoch ist und dann ein Plateau erreicht, Aceton dagegen hat eine Typ-II-Isotherme, die nach einer geringen anfänglichen Adsorption kein Plateau zeigt, sondern mit dem Partialdruck stetig weiter steigt (mehr dazu unter https://www.arnold-chemie.de/2017/10/ueber-adsorptionsisothermen-teil-ii/). Entsprechend sind auch die Durchbruchkurven von Toluol (oben) deutlich steiler als die von Aceton (unten), das eine längere Massentransfer-zone hat. (Der „Ausreißer-Lauf“ war jeweils bei deutlich niedrigerer Konzentration in der Gasphase.)
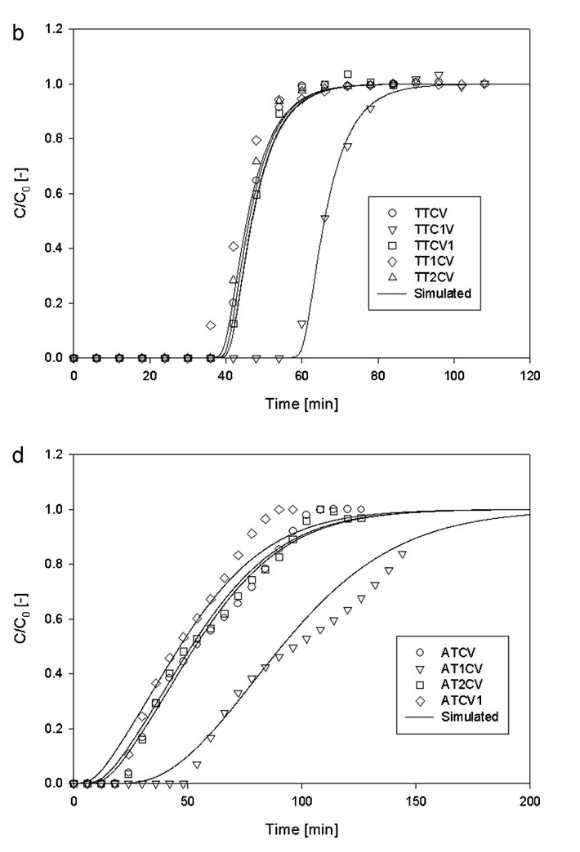
Entsprechend unterschiedlich verhalten sich auch die Desorptionskurven, die hier bei erhöhter Temperatur, nämlich bei 200 °C (473 K), gemessen wurden.
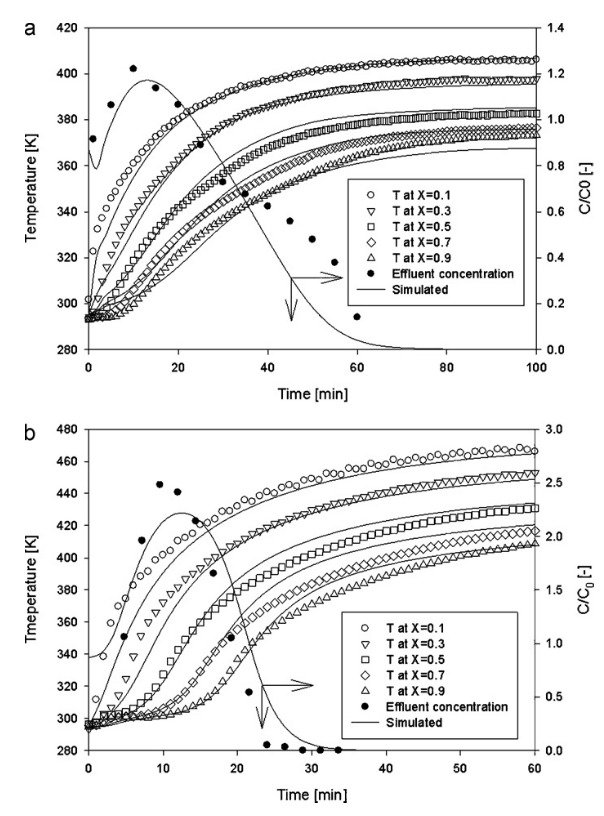
Diese Abbildung scheint zunächst etwas verwirrend: Die einzelne Kurve ist die Konzentration am Säulenausgang als Funktion der Zeit. Sie bezieht sich auf die rechte y-Achse, die Einheit ist C/C°. Folgendes fällt auf den ersten Blick auf:
- Die Desorption von Aceton beginnt augenblicklich, die mit Toluol beladene Säule durchläut zunächst eine kurze Spülphase, in der die Konzentration am Austritt sinkt.
- Das Maximum der Konzentration wird von beiden Adsorptiven zu ähnlicher Zeit erreicht – nach 10 – 12 Minuten – aber Aceton kommt mit der 2,5-fachen Konzentration der Eintrittskonzentration an, Toluol mit der 1,2-fachen Konzentration.
- Somit ist die Desorption von Aceton nach 30 Minuten beendet, bei Toluol erst nach 60 Minuten.
Die anderen Kurven sind die Messwerte verschiedener Thermometer bei 10%, 30%, 50% etc. der Säulenlänge. Sie beziehen sich auf die linke y-Achse, die Einheit ist K. Die Desorptionsluft ist 470 K heiß und diese Temperatur wird bei Aceton, vor allem am Säulenanfang, auch erreicht. Bei Toluol bleibt bis zum Ende der Versuche die gesamte Säule etwas kühler. Zwar ist dort auch mehr Adsorbat bei höherer Adsorptionsenthalpie gebunden (die benötigte Wärmearbeit für die Desorption ist also höher) als bei Aceton, aber bei Aceton bleibt das Ende der Säule im Verhältnis deutlich länger auf der Raumtemperatur, die dort vorher herrschte. Die Tatsache, dass Aceton deutlich schneller desorbiert, führt dazu, dass mehr Wärmeenergie in kurzer Zeit an das Zeolithbett abgegeben werden kann und weniger stromabwärts transportiert wird..
5. Toluol auf Aktivkohle und auf Zeolith Y
Literatur: Otten, W., Gail, E. & Frey, T. „Einsatzmöglichkeiten hydrophober Zeolithe in der Adsorptionstechnik.“ Chem.-Ing.-Tech. 64, 915–925 (1992).
Diese klassische Arbeit vergleicht vor allem Aktivkohle im Regenerations-betrieb mit dem damals neu auf dem Markt erschienenen „Wessalith“, Zeolith Y von der Degussa AG, bei welcher die Autoren angestellt waren. Die folgende Grafik wurde etwas „in Form gerechnet, der Übersichtlichkeit halber und um (vielleicht…) die Unterschiede etwas sichtbarer zu machen.
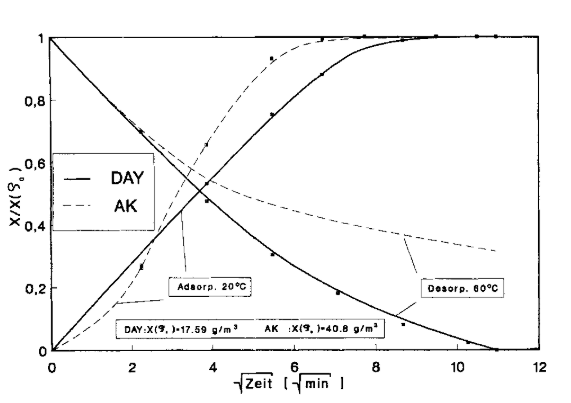
So lautet die Einheit der Abszisse √min, also Wurzel der Zeit. Das hat keinen direkt nachvollziehbaren wissenschaftlichen Hintergrund außer dem, dass sich die x-Achse mit zunehmender Zeit immer stärker zusammenschiebt und die Unterschiede somit deutlicher werden.
Die Einheit der Ordinate ist X/X(ρ0), ρ0 ist dabei die Rohgaskonzentration, bei welcher das Material beladen wurde. Bei Aktivkohle ist das 40,8 g/m³, bei DAY 17,59 g/m³. Es wird nicht gesagt, warum diese Werte gewählt wurden, und ob damit eine vergleichbare Ausgangsbeladung erzielt wurde. Vermutlich war die Beladung bei der Aktivkohle höher. Die Darstellung hat den Vorteil, dass die Beladung der Adsorbenzien nivelliert ist, ist aber gewissermaßen eine Täuschung.
Die folgende Abbildung ist ein Versuch, die Daten in eine absolute Form zu bringen, wofür aber Annahmen getroffen werden mussten: a) Die Ausgangsbeladung des DAY ist 18g/100 g (aus eigenen Messungen) und b) die Ausgangsbeladung der Aktivkohle ist 30,2 g (nach Jamal Benkhedda et al. „Experimental and Modeled Results Describing the Adsorption of Toluene onto Activated Carbon.“ J. Chem. Eng. Data 45, 650–653 (2000)).
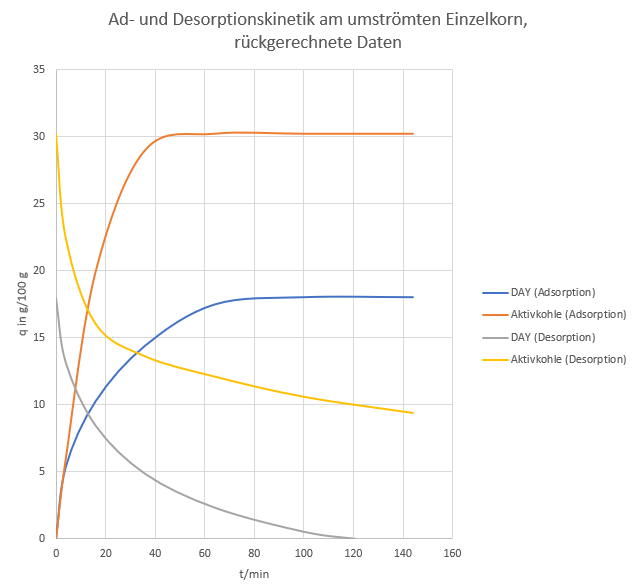
Ich halte diese Annahmen für einigermaßen realistisch. Man kann hier sehen, dass die Aktivkohle plötzlich nicht mehr so unterlegen aussieht (allerdings bei höherer Beladung, die je nach Rohgaskonzentration nicht immer erzielt wird). Zwar bleibt eine Restbeladung, der Arbeitshub ist aber mit ca. 20 g/100 g für beide Adsorbenzien ähnlich. Die ersten 15 g/100 g Arbeitshub erreicht Aktivkohle nach etwa 20 Minuten, der Zeolith nach etwa 45 Minuten. Dies deckt sich mit der allgemeinen Erfahrung, dass Aktivkohle für viele Adsorptive eine schnellere Kinetik hat.
6. Es desorbiert nicht, es brennt
Manche Verbindungen haben eine so niedrige Zündtemperatur, oder werden durch die Adsorption so stark aktiviert, dass eine Oxidation in Gang kommt, ehe die Verbindung desorbieren kann. Meist handelt es sich dabei nur um eine teilweise Oxidation, bei welcher Kohlenstoffrückstände auf dem Zeolithen zurückbleiben (sogenanntes Fouling). Diese können sich nach und nach so aufbauen, dass die Adsorptionskapazität des Zeolithen merklich zurückgeht, und bei einer Verkettung auslösender Umstände kann es manchmal zu einer Selbstentzündung dieser Rückstände auf dem an sich unbrennbaren Zeolithen kommen. Mehr dazu unter „Wenn Zeolithe brennen„.