In den folgenden Grafiken wurden die Messwerte nach verschiedenen Kriterien wie Stoffklasse, Dampfdruck, Molekülgestalt und anderen Eigenschaften, die möglicherweise den Isothermenverlauf beeinflussen, zusammengefasst.
Alkohole
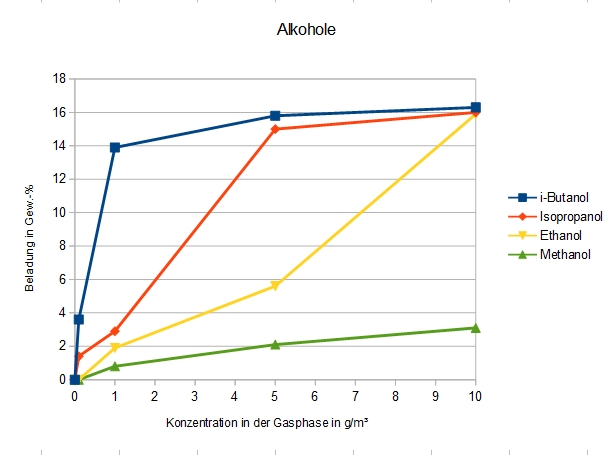
Adsorption verschiedener Alkohole an DAY
Alkohole mit niedrigem Molekulargewicht sind überraschend schlecht zu adsorbieren. Methanol zeigte auf einem anderem DAY-Zeolithen als dem in diesen Messungen verwendeten sogar eine (seltene) Typ V-Isotherme, also ein zweistufiges Adsorptionsverhalten mit zunächst einer Lage, danach einen Übergang zur Porenkondensation [1]. Dies könnte an der im Vergleich zur Porengröße eher kleinen Molekülgröße liegen, und/oder an der starken Adsorption der Moleküle an den Porenwänden und an Defekten im Kristallgitter.
Apolare Verbindungen
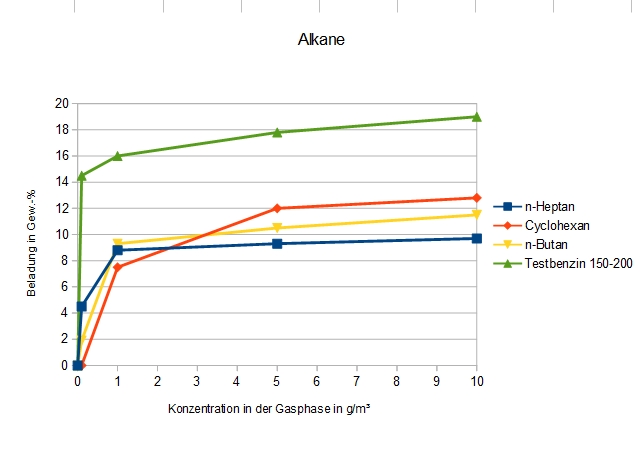
Adsorption von Alkanen an DAY
Testbenzin 150 – 200 besteht größtenteils aus C9 – C11-Paraffinen, n-Butan (C4), Cyclohexan (C6) und n-Heptan (C7) sind deutlich kurzkettiger. Es ist auffallend, dass sich die letzten drei nicht sehr unterscheiden, und dass n-Heptan schlechter adsorbiert als das deutlich flüchtigere n-Butan.
Dies könnte zumindest teilweise an Messungenauigkeiten liegen: Die Diffusionsgeschwindigkeit längerer Kohlenwasserstoffmoleküle in Zeolithen ist nicht mehr sehr groß, und eventuell wurde die Gleichgewichtseinstellung nicht wirklich abgewartet. Die im Vergleich dazu höhere Adsorptionskapazität von Testbenzin, welches hauptsächlich längerkettige Alkane als n-Heptan enthält, wäre dadurch zu erklären, dass nur die kürzerkettigen Anteile adsorbiert wurden.
Aromaten
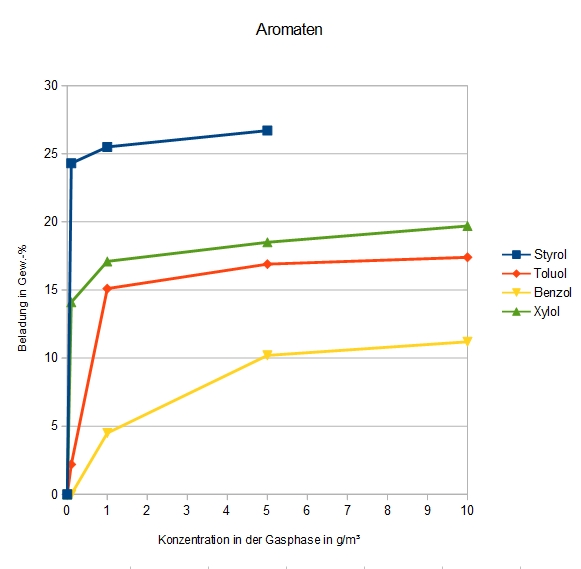
Adsorption verschiedener Aromaten an DAY
- Gerade Benzol, für welches nach TA Luft Emissionswerte von 1 mg/m³ einzuhalten sind, adsorbiert relativ schlecht bei geringen Konzentrationen.
- Xylol stellt eine Mischung aller Xylole dar, welche sich mit dem großporigen DAY nicht mehr trennen lassen.
- Styrol ist, wie die Regeneration zeigte, nicht auf dem Zeolithen polymerisiert. Dies kann jedoch grundsätzlich passieren, insbesondere während der Regenerationsphase bei erhöhter Temperatur.
Ester
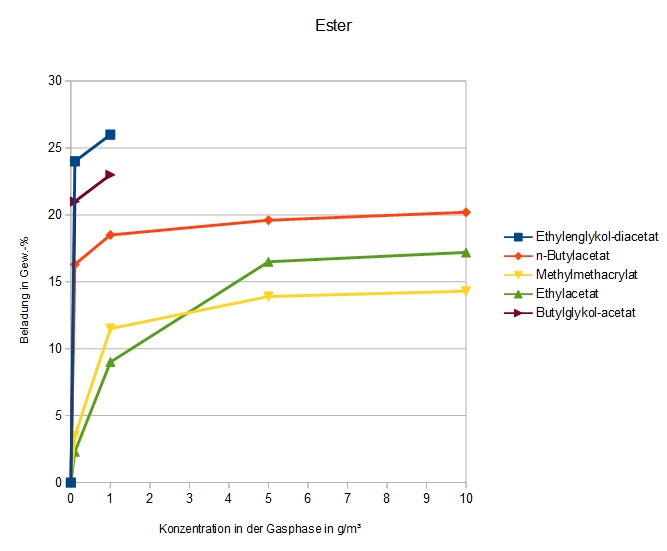
Adsorption von gesättigten und ungesättigten Mono- und Diestern auf DAY
Die Glykolester sind so wenig flüchtig, dass nur zwei Messpunkte aufgenommen werden konnten. Es ist daher nicht zu sagen, ob die Verbindungen sich tatsächlich wie bei einer Adsorption auf Zeolithen verhalten, oder ob sie überall auf den inneren und äußeren Oberflächen kondensieren.
Auch Methylmethacrylat – ein Monomer – ist bei diesem Versuch nicht polymerisiert.
Sechsringe
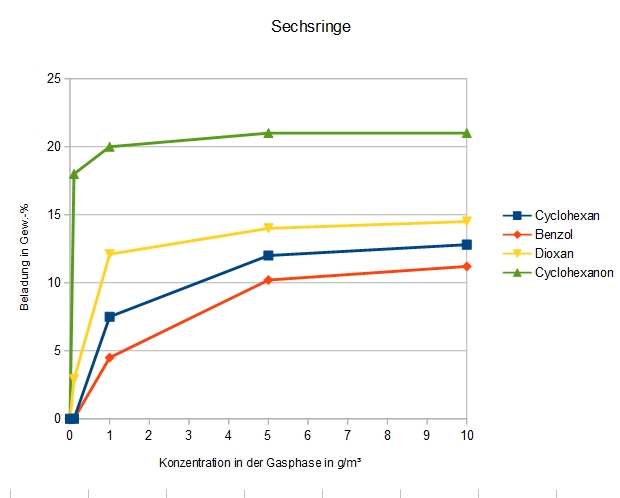
Adsorption von Molekülen mit einem Sechsring-Grundkörper an DAY
Ähnliche Molekülgestalt, aber mit unterschiedlicher Polarität. Hier ist ganz klar eine Staffelung nach Siedepunkten, bzw. Dampfdrücken zu beobachten. Die hohe Polarität von Dioxan spielt anscheinend keine große Rolle bei der Adsorption.
Ähnlicher Dampfdruck
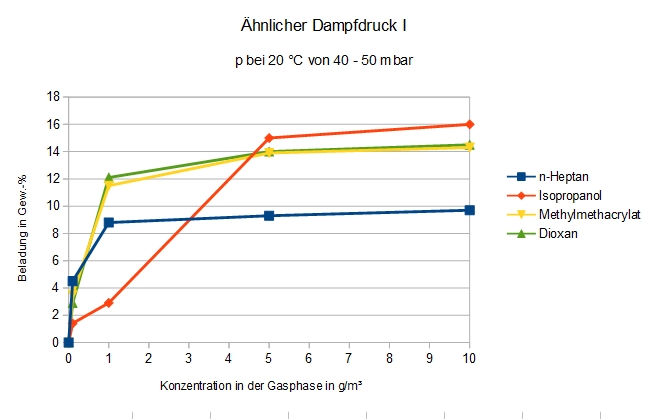
Adsorption von Verbindungen mit einem Dampfdruck zwischen 40 und 50 hPa bei 20 °C
Der Dampfdruck ist nicht das allentscheidende Kriterium: Die merkwürdige Sonderstellung der Alkohole macht sich auch hier bemerkbar.
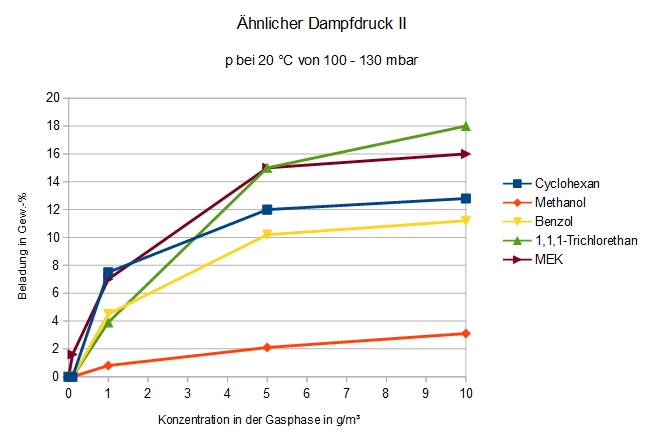
Adsorption von Verbindungen mit einem Dampfdruck von 100 bis 130 hPa bei 20 °C
Die flüchtigeren Verbindungen zeigen alle einen anfangs etwas abgeflachten Kurvenverlauf und Methanol ist im Vergleich dazu auffallend schlecht adsorbierbar.
Ähnlicher Siedepunkt
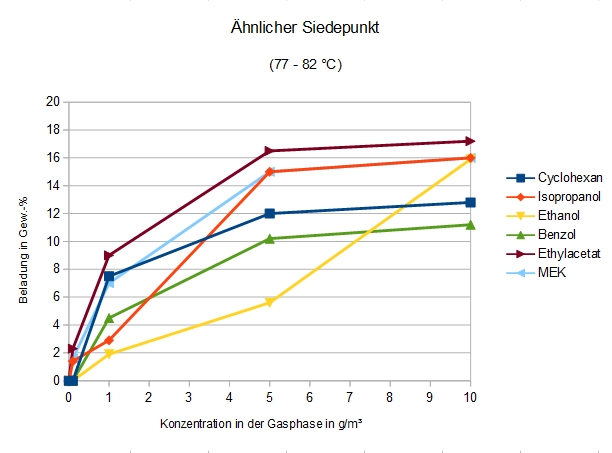
Adsorption an DAY von Verbindungen mit ähnlichem Siedepunkt
Dies ist eine ganz ähnliche Betrachtung wie die des Dampfdruckes. Zwar scheint die Flüchtigkeit eine der entscheidenden Eigenschaften für die Adsorbierbarkeit zu sein, aber diese Verbindungen, die alle innerhalb eines Temperaturbereiches von 5 °C sieden, haben zum Teil eine um den Faktor 4 unterschiedliche Adsorbierbarkeit. Besonders im niedrigen Konzentrationsbereich, bis etwa 2 g/m³, in welchem die meisten Abluftreinigungsanlagen auf Zeolithbasis laufen, sind die Unterschiede sehr hoch.
Ähnliches Molekulargewicht
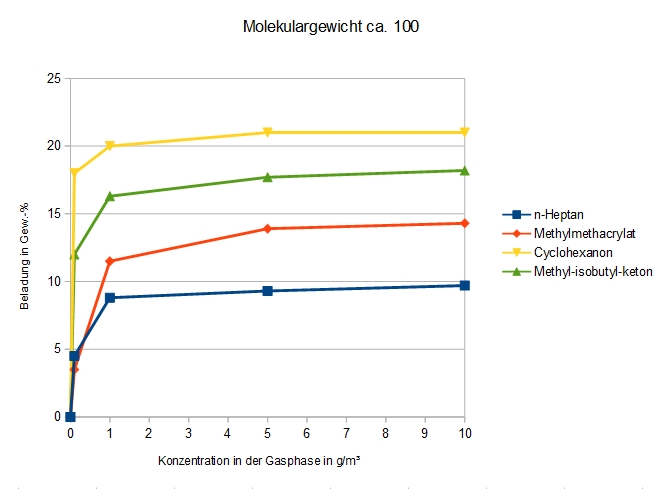
Vier chemisch unterschiedliche Verbindungen mit ähnlichem Molekulargewicht werden hinsichtlich ihrer Adsorption an DAY verglichen.
Das Molekulargewicht ist für sich alleine nicht entscheidend für die Adsorbierbarkeit einer Verbindung.
Ketone
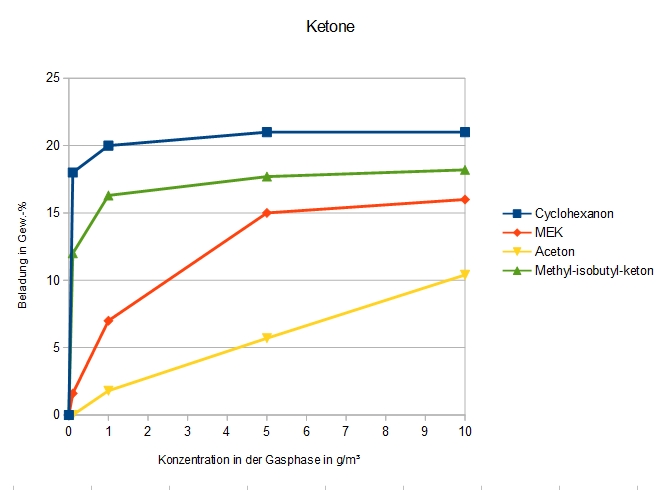
Adsorption verschiedener Ketone an DAY
Aceton ist ein weiterer bekannter Problemfall für die Adsorption an DAY: Im Bereich niedriger Konzentrationen ist die Adsorptionskapazität von DAY für Aceton relativ gering, weswegen in solchen Fällen meist ein anderer Zeolith – allein, als geschichtetes oder Mischbett – verwendet wird. Ansonsten ist eine Staffelung nach Siedepunkt zu beobachten.
Halogenkohlenwasserstoffe HKW
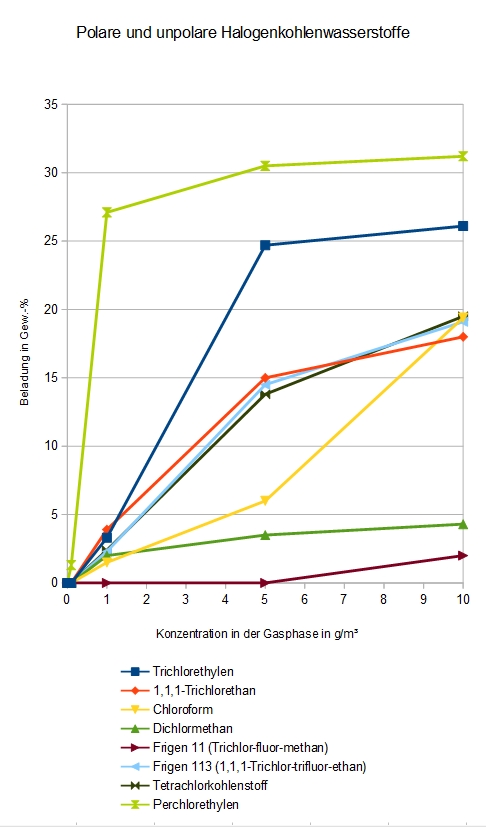
Adsorption verschiedener halogenierter Kohlenwassestoffe an DAY
Die unter „Halogenkohlenwasserstoffe“ zusammengefassten Verbindungen unterscheiden sich stark, vom Molekulargewicht bis hin zur Flüchtigkeit. Es ist kein Zusammenhang irgendwelcher Eigenschaften und der Adsorbierbarkeit zu erkennen. Zur Überprüfung habe ich die selben Daten noch einmal auf Zahlenbasis, in mol/m³ für die Gasphase und mol/100 g für die Beladung ausgedrückt:
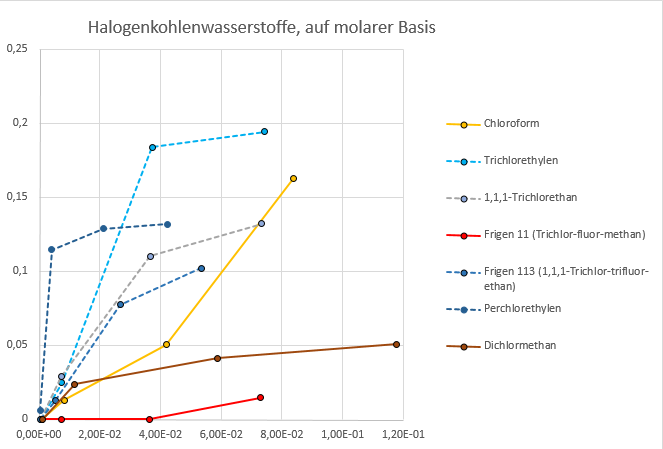
Halogenkohlenwasserstoffe auf Zeolith DAY, in molaren Einheiten ausgedrückt
Es zeigt sich nun, dass von den größeren und schwereren Molekülen nicht nur auf Massen-, sondern auch auf Zahlenbasis mehr adsorbiert wird, d. h. bei der gleichen Zahl an Molekülen in der Gasphase sitzen im Gleichgewichtszustand z. B. von Trichlorethylen beinahe vier mal so viele Moleküle in jeder Elementarzelle wie von Dichlormethan.
Es ist nachträglich allerdings nicht mehr festzustellen, wie viel der flüchtigeren Substanzen auf diffusen Wegen verschwand. Bei der Handhabung von Lösungsmitteln wie Methylenchlorid oder Trichlor-fluormethan ist dies wegen ihrer extremen Flüchtigkeit immer ein Problem. Der Verlauf der Kurven der C1-Verbindungen (durchgezogene Linien) zeigen eine starke Abhängigkeit der Kapazität des Molekularsiebes von der Konzentration des Adsorbates, während die C2-Verbindungen (gestrichelte Linien) eher ein Sättigungsniveau erreichen. Das bedeutet, dass für die C1-Verbindungen [2] der Partialdruck des Adsorptivs eine große Rolle beim Adsorptionsgleichgewicht spielt. Das hat zur Folge, dass Schwankungen der Eingangskonzentration auch wieder zu Desorption führen können und die Massentransferzone im Adsorber im Verlauf der Adsorption immer breiter wird: Ein Konzentrator ist unter diesen Bedingungen meistens nicht zu realisieren – dafür aber ein Glättungsfilter.
[1] Istvan Halasz , Song Kim , and Bonnie Marcus: „Uncommon Adsorption Isotherm of Methanol on a Hydrophobic Y-zeolite.“ J. Phys. Chem. B, 2001, 105 (44), pp 10788–10796. DOI: 10.1021/jp0103530
[2] Das gilt auffallend auch für den C1-Alkohol Methanol.