Zeolithe
Zeolithe sind eine Gruppe von Mineralien mit der allgemeinen Formel
Mx/n[(AlO2)x(SiO2)y] . z H2O
und einer besonderen Eigenschaft: Wie alle Mineralien sind auch Zeolithe Salze, also aus Kationen (positive Ionen) und Anionen (negative Ionen) aufgebaut.
Während die Kationen (z. B. Na+, in der Formel durch M dargestellt) wie bei gewöhnlichen Salzen einzelne Teilchen sind, sind die zugehörigen Anionen gitterartige, weit ausgedehnte Aluminosilikat-Strukturen aus Silizium, Aluminium und Sauerstoff.
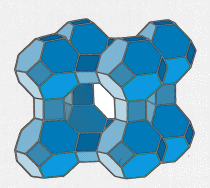
Die Abbildung zeigt schematisch den Aufbau von Zeolith A (dem meistverwendeten synthetischen Zeolithen), wobei jede gerade Kante eigentlich eine gewinkelte Sauerstoffbrücke -O- ist und an den Ecken die Aluminium- bzw. Siliziumatome sitzen (realistische Gittermodelle findet man in der Strukturdatenbank der IZA, der International Zeolite Association). Der Hohlraum in der Mitte zeigt den größten Hohlraum, den die Struktur aufzuweisen hat. Die anderen Teile der Struktur sind geschlossen gezeichnet, da sie zu klein und gewöhnlich nicht zugänglich sind. Je nach Aufbau der Struktur sind die Poren zu ein- oder mehrdimensionalen, geradlinigen oder zick-zack-förmigen Kanalsystemen verbunden.
In den Porenöffnungen der ausgedehnten „Riesenanionen“ sitzen die Kationen und haben dort eine gewisse Bewegungsfreiheit. Sie können von einer Pore in die nächste wandern oder auch das Gitter verlassen.
So kommt es, dass die Kationen verhältnismäßig leicht ausgetauscht werden können (Einsatz der Zeolithe als Enthärter z. B. in Waschmitteln) und dass sich neutrale Moleküle zusätzlich in den Poren anreichern können.
Herkunft
Zeolithe finden sich einmal als natürliche Mineralien. Sie haben z. T. sehr unterschiedliche chemische Zusammensetzungen und daher auch unterschiedliche Eigenschaften als Adsorptionsmittel oder Ionenaustauscher. Diese schwanken nicht nur von Zeolithtyp zu Zeolithtyp, sondern hängen auch von der Fundstelle ab. Zum Teil variieren sie sogar innerhalb der selben Lagerstätte.
Bei den modernen industriellen Anwendungen (z. B. Katalyse) kommt es jedoch sehr auf das genaue Einstellen und die Konstanz der gewünschten Eigenschaften an. Daher sind die meisten in der Technik verwendeten Zeolithe vollsynthetisch hergestellt, trotz ihrer im Vergleich zu natürlichen Zeolithen deutlich höheren Preise.
Mehr zum Thema „Natürliche und synthetische Zeolithe im Blog: Teil I und Teil II.
Eigenschaften
Es sind vor allem zwei Parameter, die das Verhalten eines Zeolithen als Adsorbens charakterisieren:
Form und Größe der Pore
Große Poren können größere Moleküle aufnehmen als kleine Poren (aus räumlichen Gründen), daher der „Siebeffekt“ und die Bezeichnung Molekularsieb. Kleine Poren binden die Teilchen fester als große Poren (wegen der von allen Seiten wirkenden Bindungskräfte).
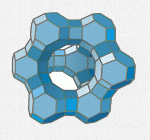
Die Abbildung zeigt einen Ausschnitt aus der Struktur von Zeolith X, der deutlich größere Poren aufweist als Zeolith A. Die Porenöffnung wird von 12 Si/Al-Atomen begrenzt, statt von 8, wie beim Zeolith A. (Tatsächlich ist die Größe der Zeolith A-Elementarzelle 420 pm, die der Zeolith X-Elementarzelle 1140 pm. Kinetischer Durchmesser eines Wassermoleküls: 145 pm.)

Schematischer Größenvergleich der Poren von Zeolith A, X und „Z“
Einen maßstabgetreuen Größenvergleich der Zeolithporen untereinander zeigt die folgende Abbildung. Die kleinste Form entspricht der Porenöffnung von Zeolith A (8 Si- bzw. Al-Atome im Ring), die größte der von dem Faujasiten Zeolith X (12-Ring), die mittlere zeigt einen 10-Ring, wie ihn z. B. ZSM-5 aufweist. Die nach innen gerichteten Ecken sind die Sauerstoffatome.
Mehr zum Einfluss der Molekül- und Porengröße im Blog: „Kinetischer Durchmesser und Molekularsieb-Effekt„.
Pulver und Formkörper
Ebenfalls sehr wichtig und schwierig zu kontrollieren ist der Einfluss der äußeren Form. Feine Pulver können für Adsorptionsanlagen naturgemäß nicht verwendet werden. Für Pellets oder Wabenkörper muss das aus wenige Mikrometer großen Kristalliten bestehende Zeolithpulver mit einem Bindemittel (etwa Ton) in Form gebracht, durch Brennen gehärtet und dabei gleichzeitig ein Transportporensystem geschaffen werden.
Das Bindemittel kann einen beträchtlichen Gewichtsanteil des Adsorbens ausmachen (typischerweise 5 – 15%) und beeinflusst dessen Charakteristika, vor allem die Stofftransporteigenschaften. Es ist auch das Bindemittel, welches bei Kontakt mit Wasser umkristallisiert und durch Ausbildung großer Kristallplättchen den Zugang zu den eingebetteten Zeolith-Partikeln blockiert.
Die chemische Zusammensetzung und die Polarität
Die chemische Zusammensetzung, insbesondere das Si/Al-Verhältnis des Gitters, bestimmt die Ladungsverteilung in der Oberfläche der Pore und somit die Selektivität für polare oder apolare Moleküle. Hydrophile Zeolithe wie A und X haben Si/Al-Verhältnisse nahe 1. Da jedes Aluminiumion im Gitter zu einer negativ geladenen Stelle führt und daneben die Gegenionen (Na, K oder Ca) in das Gitter eingebettet sind, haben diese Zeolithe eine ungewöhnlich heterogene innere Oberfläche mit starken Feldgradienten. Dies bedingt ihre extreme Anziehungskraft für polare Moleküle wie Wasser.
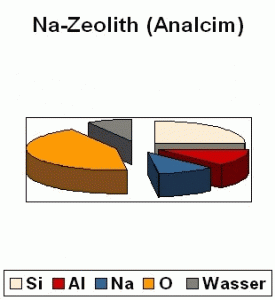
Das Tortendiagramm zeigt die Zusammensetzung eines natürlichen Natriumzeolithen, Analcim. Bei diesem Mineral beträgt das Verhältnis von Silizium zu Aluminium, das Si/Al-Modul, 2, d. h. es ist doppelt so viel Silizium wie Aluminium vorhanden. Durch moderne Produktionsverfahren lässt sich das Modul auf Werte von > 3.000 bringen.
Hydrophile und hydrophobe Zeolithe
Pauschal kann man sagen: je mehr Aluminium und je weniger Silizium ein Zeolith enthält, desto dichter ist die negative Ladung in seinem Gitter und desto polarer seine innere Oberfläche. Aluminiumreiche Zeolithe schließen darum in ihre Poren – neben den Kationen – am ehesten sehr polare neutrale Moleküle ein. Klassisch ist die feste Adsorption von Wasser an 3A-Zeolith. Damit kann man Spuren von Wasser aus Lösungsmitteln herausholen.
Die Physisorptionskräfte, die auf apolare Moleküle wie z. B. Kohlenwasserstoffe wirken, sind so gering, dass diese Moleküle nicht festgehalten werden. Solche Zeolithe bezeichnet man als hydrophil (= „wasserliebend“).
Für die Technik interessanter ist der entgegengesetzte Fall: Aus großen Mengen von Wasser die wenigen organischen Bestandteile herauszuholen, etwa zur Anreicherung aus Wasser oder zur Anreicherung von Lösungsmitteln aus einem (luftfeuchten) Gasstrom zum Zwecke der Abluftreinigung. Wenn man dies mit einem hydrophilen Molekularsieb versucht, bindet man hauptsächlich die Luftfeuchtigkeit.
Man braucht also ein Molekularsieb, welches die Porenstruktur, nicht aber die Ladung eines Zeolithgerüstes hat.
Es gibt verschiedene Verfahren, Anteile des Aluminiums zu extrahieren (wenn man dies zu weit treibt, bricht das Zeolithgerüst zusammen) oder während des Herstellprozesses die [AlO4]-Bausteine durch [SiO4]-Bausteine zu ersetzen. Ergebnis dieser Verfahren sind die hydrophoben („wasserabweisenden“) Zeolithe, also solche, die bevorzugt unpolare Moleküle wie etwa Toluol adsorbieren. Die Si/Al-Verhältnisse können höher als 3.000 sein. Diese Zeolithe binden apolare Lösungsmittel besser als Wassermoleküle, das bedeutet jedoch nicht, dass sie gar kein Wasser oder sonstige polare Moleküle (wie H2S oder NH3)adsorbieren.
Reaktionen auf dem Zeolithen
Ein adsorbiertes Molekül ist immer auch mehr oder weniger aktiviert. Unter ungünstigen Umständen kann eine brennbare Verbindung, die bei Anwesenheit von Sauerstoff gewöhnlich nicht spontan verbrennt, auf einem Zeolithen adsorbiert sehr wohl verbrennen, ohne dass ein Zündfunke nötig wäre. Es genügt dafür die feine Verteilung des Adsorbates auf dem Molekularsieb, die Aktivierung durch die Adsorption und die Exothermie des Adsorptionsvorganges sowie eines nach und nach einsetzenden Oxidationsvorganges. Einige Schwefelverbindungen (etwa Mercaptane) sind in dieser Hinsicht geradezu berüchtigt.
Mehr zur Selbstentzündung von Adsorbern finden Sie im Blog: „Selbstentzündung von lösemittelgetränkten Materialien“ und „Wenn Zeolithe brennen“.
Auch eine Polymerisationsreaktion kann auf dem Zeolithen starten, wenn reaktionsfähige Monomere darauf adsorbiert sind. Der Zeolith lässt sich dann nur mit recht drastischen Methoden regenerieren.
Hydrophobe Zeolithe sind einigermaßen säurebeständig, aber basenempfindlicher als hydrophile Typen. Die Säurestärke ihrer sauren Zentren ist zudem sehr viel höher, auch wenn sie eine geringere Zahl solcher sauren Zentren haben. Dies liegt daran, dass die wenigen Aluminiumatome im Gitter sehr isoliert und ihre Ladung somit nicht verteilt wird. Man kann auf diesen Zeolithen säurekatalysierte Reaktionen ablaufen lassen. Besonders unangenehm ist z. B. die Tendenz vor allem der Carbonsäureester, aber auch der Ketone, Alkohole und einiger anderer Verbindungsklassen, auf dem Zeolithen durch Zerfall organische Säuren zu bilden, welche mit der Zeit das Adsorbens und die Anlage beschädigen (Korrosionsschäden dort, wo Desorbate kondensieren).
Adsorptionsverhalten
Adsorption ist immer ein exothermer Vorgang. Wenn man bei einem Molekularsieb eine Adsorptionskapazität für einen Stoff angegeben findet, geht man stillschweigend (zumindest bei den einfacheren Isothermenmodellen wie der Langmuir-Isotherme) von der Annahme aus, dass die Enthalpie immer gleich bleibt, unabhängig von der Beladung des Adsorbens. Dies ist jedoch ein Idealfall; in der Praxis wird die Adsorptionsenthalpie bei steigender Beladung immer kleiner und eine weitere Adsorption ist nur noch durch höhere Partialdrücke des zu adsorbierenden Stoffes in der Gasphase zu erzwingen. Weiteres auf der folgenden Seite unter “Interpretation”.
Weiter zu den Messungen