Für die Überlassung der Messergebnisse danke ich der Omega Technology GmbH.
Experimentelle Methode
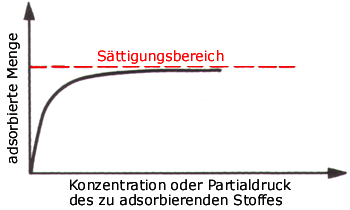
Eine beispielhafte Isotherme vom Typ I
Die Adsorptionsisotherme ist die Kurve, die die Beziehung zwischen Partialdruck des Adsorbaten und der Beladung des Molekularsiebes darstellt. Als Beispiel ist hier eine schematische Isotherme vom Typ I dargestellt, wie man sie häufig bei der Adsorption von organischen Verbindungen auf Zeolithen antrifft.
Die hier gezeigten Isothemen wurden gravimetrisch aufgenommen: Eine definierte Menge Molsieb DAY der Degussa Hüls AG wurde in ein 10 cm hohes Röhrchen von 3 cm Durchmesser (einen sog. „Trap“) eingefüllt und gewogen. Bei 20 °C wurde es einem mit der angegebenen Menge Lösungsmitteldampf beladenen Gasstrom ausgesetzt.
Mit einem Flammenionisations-Detektor oder mittels Gaschromatografie wurde beobachtet, wann der Durchbruch auftrat (der Durchbruch ist der Zeitpunkt, an dem das Molsieb so stark beladen ist, dass es Lösungsmittelmoleküle durchlässt, statt sie zu adsorbieren, so dass die Konzentration am Austritt der am Eintritt entspricht). Der ausgebaute Trap wurde noch einmal gewogen und die adsorbierte Menge mittels Differenzbildung bestimmt.
Danach wurde das Molsieb bei 50 mbar Druck und 60 °C ohne Spülgas desorbiert, bis es sein ursprüngliches Ausgangsgewicht wieder erreicht hatte. Die adsorbierte Menge wurde so in Abhängigkeit von der Konzentration im Gasstrom gemessen.
Über die Auswertung
Die Messungen sind nur untereinander vergleichbar: Das hier verwendete Material wird seit einigen Jahren nicht mehr hergestellt und unterscheidet sich durch das verwendete Dealuminierungsverfahren von den heute verfügbaren Produkten. Außerdem war der verwendete Trap sehr klein, so dass angesichts der Pelletgrößen von 4 – 7 mm eine Übertragbarkeit der Ergebnisse auf größere Apparate nicht gegeben ist.
Diese sehr umfangreichen, aber ohne viel theoretische Vorplanung durchgeführten Versuche sollten ein praktisches Maß dafür ergeben, wie viel eines bestimmten Lösungsmittels das Molekularsieb aufnehmen kann. Die Auswertung und der Vergleich der Isothermen untereinander sollen zeigen, ob und wieweit von den Stoffeigenschaften des Adsorptivs auf das Adsorptionsverhalten geschlossen werden kann.
Rückgewinnung der Lösungsmittel?
Aus diesen Versuchen geht nicht hervor, ob sich die Adsorption als Verfahren zur Wiedergewinnung der einzelnen Lösungsmittel eignen würde, da Qualität und Menge der desorbierten Verbindungen nicht bestimmt wurde. Immerhin ist die gefürchtete Polymerisation auf dem Träger von Verbindungen wie Styrol und Methylmethacrylat ausgeblieben.
Dies ist jedoch in hohem Maße eine Frage des Zufalls – und der Anlagendimension: Sich thermisch selbst beschleunigende Reaktionen wie z. B. die Selbstentzündung brennbarer Verbindungen auf Zeolithen oder Polymerisationen laufen eher in großen Anlagen als in Mini-Laboranlagen ab.
Die Bedingungen, unter denen ein beladenes Molekularsieb wieder desorbiert werden kann, sind von großem praktischen Interesse. Fälle, in denen sich Substanzen irreversibel bzw. teilweise reversibel binden oder nur mit sehr hohem Energieaufwand desorbiert werden können, kommen in der Praxis immer wieder vor.
Adsorptionstyp
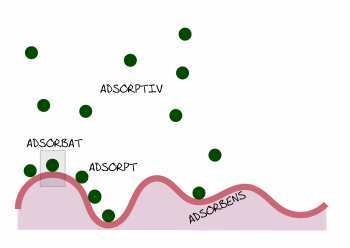
Adsorptionsbegriffe bildhaft erklärt
Der Verlauf der so ermittelten Kurven ist von großem praktischen Interesse: es interessiert vordringlich der Konzentrationsbereich, in dem später auch die zu behandelnde Abluft vorliegen wird. Optimal sind Adsorbens-Adsorptiv-Kombinationen, bei denen im zu behandelnden Konzentrationsbereich der Kurvenverlauf bereits ein möglichst horizontaler ist (und das natürlich bei möglichst hohen Beladungen), der konzentrationsabhängige Bereich der Kurve also bei geringeren Konzentrationen liegt. Sonst kann es bei schwankenden Eingangskonzentrationen zu Desorptionsvorgängen, der Verteilung des Adsorptes auf der gesamten Schüttung und somit zu verfrühten Durchbrüchen kommen.
Zusammenstellung der Messwerte
Die Messwerte sind in einer Excel-Tabelle zusammengestellt, die Sie sich herunterladen [Link] können.
Die so ermittelten Isothermenwerte stellen einen Gleichgewichtszustand dar, ohne Berücksichtigung von zeitabhängigen Faktoren. Sie können daher nicht ohne weiteres auf größere Anlagendimensionen hochgerechnet werden. Sie eignen sich jedoch, um das Adsorptionsverhalten verschiedener organischer Verbindungen miteinander zu vergleichen.
Insbesondere interessierte die – in der Praxis oft betriebene – Extrapolation innerhalb einer Stoffgruppe: Wenn sich Ethanol adsorbieren lässt, dann muss es mit Propanol ja auch einigermaßen klappen – oder nicht? Kann man vom Adsorptionsverhalten eines Stoffes auf das eines Homologen schließen?
Die Tabellenwerte sind grafisch ausgewertet worden: Moleküle mit ähnlichem Siedpunkt wurden verglichen, ebenso Moleküle mit ähnlicher Polarität oder unterschiedlicher Polarität bei ähnlicher Geometrie und eine, wenn auch „unsaubere“, Homologenreihe der Alkohole.
Interpretation der Kurven
Wie bereits oben geschrieben, ist ein “praktischer” Kurvenverlauf, bei dem der ansteigende Bereich so kurz wie möglich und der obere Kurvenast möglichst konzentrationsunabhängig, also waagerecht im Diagramm verläuft, günstig, wenn dieser Stoff in einer Molekularsiebanlage adsorbiert werden soll. Ein solcher Kurvenverlauf bedeutet, dass die Kapazität des Molekularsiebes nur wenig von der Konzentration des Schadstoffes im Abluftstrom abhängt. Adsorbiert wird immer gleichviel; wenn die Konzentration geringer ist, dauert es länger, bis das Adsorberbett regeneriert werden muss. Konzentrationsschwankungen im Rohgas – solange man sich dabei im horizontalen Bereich der Kurve (also dem Sättigungsbereich) bewegt, haben kaum Einfluss auf die Reingaswerte.
Anders hingegen, wenn die Kurve stetig ansteigt und die Kapazität des Molekularsiebes sich mit der Rohgasbeladung immer weiter erhöht: Dies bedeutet, der Adsorptions-Desorptions-Vorgang zeigt ein stark konzentrationsabhängiges Verhalten. Je höher der Partialdruck des Adsorbates in der Gasphase, desto höher auch die Belegung des Molekularsiebes. Oder andersherum: Je stärker das Molekularsieb schon belegt ist, desto höher muss der Partialdruck des Adsorbates in der Gasphase sein, damit noch mehr Substanz adsorbiert wird.
Eine weitere Konsequenz ist, dass bei sinkender Rohgaskonzentration eine Teildesorption stattfindet.
Fazit
Nach der Auswertung zeichnet sich folgender Trend ab: Sehr polare, kleine Moleküle wie Methanol werden nicht in nennenswerten Mengen adsorbiert, auch nicht die niedermolekularen halogenierten Kohlenwasserstoffe. Ob dies im Fall der halogenierten Kohlenwasserstoffe an Messfehlern auf Grund von diffusen Verlusten oder tatsächlich an schlechter Adsorbierbarkeit liegt, ist in dieser Versuchsreihe nicht untersucht worden (und mit der verwendeten Laboranlage auch nicht zu klären).
Ansonsten begünstigt – auch wenn man von hydrophobem Molekularsieb spricht – eine gewisse Polarität die Adsorption. Das Molekularsieb verhält sich nicht dem Idealtyp eines völlig hydrophoben Adsorbens entsprechend. Es hat eine gewisse Polarität beibehalten.
Der Siedepunkt spielt eine unübersehbare Rolle; leichtersiedende Moleküle werden in geringerer Menge adsorbiert.
Oft wird angenommen, man könne über die chemischen Eigenschaften eines Moleküls dessen Adsorbierbarkeit am Molekularsieb einfach vorhersagen. Die Fragestellung ist aber sehr komplex – und hängt in sehr hohem Maße auch von den Rahmenbedingungen des Versuches ab. Sehen Sie sich die Kurven am besten selbst an.
Weiter zu den Isothermen.