Desorption ist die Umkehrung der Adsorption, also die Freisetzung von flüchtigen oder löslichen Verbindungen aus einem Adsorbat. Theoretisch müsste, wer Einwegadsorbens verwendet (wer also das beladene Adsorbens austauscht und es nicht in der Anlage regeneriert), sich um Desorption nicht kümmern. Desorption kann jedoch auch ungewollt auftreten – jedes Mal, wenn die Verhältnisse, die vorher die Triebkraft für die Adsorption geliefert haben, sich umkehren.
Die Adsorption:
- findet bevorzugt bei tieferen Temperaturen statt
- findet bevorzugt bei konzentrierterer fluider Phase statt
- wird durch hohen Druck begünstigt
- tritt bevorzugt für das Adsorptiv mit der höheren Gleichgewichtsbeladung bei der gegebenen Konzentration ein
- hat eine niedrigere Aktivierungsenergie.
Die Desorption:
- findet bevorzugt bei höheren Temperaturen statt
- wird durch eine verdünntere fluide Phase begünstigt
- findet bevorzugt bei niedrigerem Druck statt
- bevorzugt das Adsorbat, welches bei den gegebenen Bedingungen die niedrigste Gleichgewichtsbeladung hat
- hat eine höhere Aktivierungsenergie.
Fahrweisen der Desorption
Die Desorption ist der energieverschlingende Schritt im Prozess. Um eine Desorption zu erzwingen, hat man die folgenden Möglichkeiten:
- Thermische Desorption: Man erhitzt das System. Das geschieht am einfachsten mittels Durchleiten von Heißgas, aber auch Ansätze mit Radiowellen- und Mikrowellenerwärmung wurden getestet.
- Druckwechseldesorption: Man erniedrigt den Druck durch (Teil)Evakuierung des Systems.
- Glättungsfilter: Man verdünnt die fluide Phase, indem man reines Trägergas (meist Luft) durchleitet. Verdünnung findet schon statt, wenn die Konzentration der VOC im Rohgas abnimmt, wenn etwa die Beladung nur zu bestimmten Zeiten auftritt.
- Verdrängungsdesorption: Man schafft Verhältnisse, unter denen eine andere Komponente eine höhere Gleichgewichtsbeladung hat, indem man ein Adsorptiv in sehr hoher Konzentration durchleitet und dabei das vorher gebundene Adsorpt verdrängt. Auch dieser Vorgang kann ungeplant stattfinden, wenn etwa verschiedene VOC zu unterschiedlichen Zeiten durch das Adsorbens strömen. Ein klassisches Beispiel ist die Kombination von Toluol und Methylenchlorid: Toluol wird schon in niedrigeren Konzentrationen soviel besser adsorbiert, dass es das vorher adsorbierte Methylenchlorid verdrängt.
Einfluss der Aktivierungsenergie
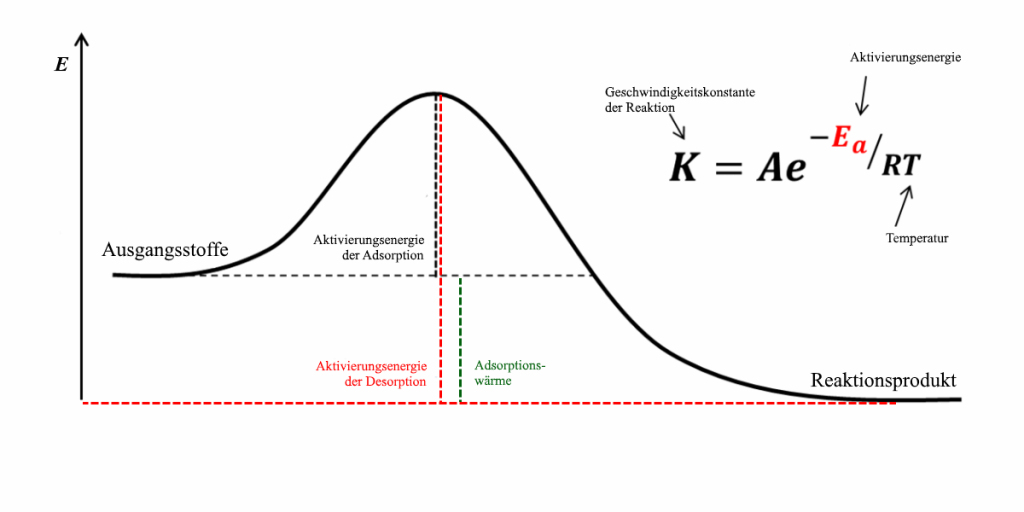
- Weil die Adsorption immer ein exothermer (Energie freisetzender) Vorgang ist, muss für die Desorption eine wesentlich höhere Energiebarriere überwunden werden als bei der Adsorption.
- Nur diejenigen adsorbierten Moleküle, die gerade das „energetische Lösegeld“, nämlich die (rot eingetragene) Aktivierungsenergie der Desorption aufbringen können, desorbieren auch.
- Je höher die Temperatur T und je geringer die Aktivierungsenergie EA, desto größer wird die Geschwindigkeitskonstante K der Desorption. Die Desorption ist also schnell bei schwach adsorbierenden Komponenten (kleines EA) und hohen Temperaturen, langsam bei hohem EA und tieferen Temperaturen.
- „Gut adsorbierende“ Verbindungen – solche, die schon bei geringeren Konzentrationen stark adsorbieren und eine merkliche Adsorptionswärme (grün) erzeugen, haben eine sehr hohe Aktivierungsenergie der Desorption. So kommt es, dass man bei vielen Adsorptiven durchaus reine Luft durch einen beladenen Adsorber schicken kann, ohne dass es zu nennenswerter Desorption kommt. Mit schwach adsorbierenden Verbindungen dagegen – etwa Butan oder dem bereits erwähnten Methylenchlorid – kommt es ziemlich schnell wieder zu einer Freisetzung der VOC, wenn Reinluft durch den Adsorber strömt.
Einfluss der Diffusion
Alle diese thermodynamischen Einflussfaktoren beschreiben, welche Gleichgewichtslage sich einstellen sollte. In bestimmten Fällen kann jedoch die Geschwindigkeit, mit der desorbierende Moleküle aus dem Porensystem in die fluide Phase wandern, so klein sein, dass entweder das Gleichgewicht sich „nie“ einstellt oder dass das zwar stärker gebundene, aber schneller diffundierende Molekül zuerst erscheint.
Häufig sieht man das, wenn das Adsorptivmolekül sehr groß für die Pore ist, also gerade eben hineinpasst. Ein Beispiel sind langkettige Kohlenwasserstoffe (etwa Diesel), die durch ihre Neigung, knäuelförmige Konformationen anzunehmen, nur extrem langsam diffundieren. (Siehe dazu auch den Blogbeitrag „Kinetischer Durchmesser„.)
Eine andere Ursache für langsame Diffusion ist der gut gemeinte Versuch, durch noch mehr Unterdruck eine Desorption zu beschleunigen oder zu vervollständigen. Ab einem bestimmten Verhältnis von Druck und Porendurchmesser geht dann plötzlich (fast) gar nichts mehr. Mehr dazu steht im Blogbeitrag über Knudsen-Strömung.