![Adsorption von verschiedenen Heteroaromaten auf Aktivkohle, aus [1]](http://www.arnold-chemie.de/wp2016/wp-content/uploads/2016/07/Kim-2006.jpg)
Abb. 1: Adsorption von verschiedenen Heteroaromaten auf nickeldotiertem Aluminosilikat, aus [1]
Dieses Überschwingverhalten wird in der Literatur gewöhnlich als „roll-up phenomenon“ bezeichnet. Im flüssigen Zustand ist es gewöhnlich schärfer ausgeprägt als in der Gasphase und wird z. B. in der Chromatographie zur Anreicherung von Wirkstoffen verwendet. Was treibt diesen Vorgang an?
Was gibt der Durchbruchkurve ihre Form?
[Adsorptiv] * [Freie Adsorptionsplätze] →/← [Adsorbat]
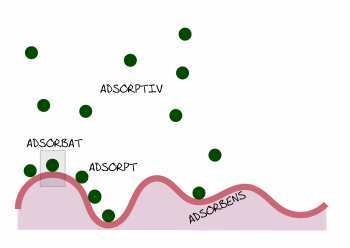
Abb. 2: Adsorptionsglossar
Das chemische Gleichgewicht zwischen den freien Adsorptionsplätzen und dem Adsorptiv in der fluiden Phase einerseits und dem Adsorbat andererseits bestimmt, wieviel Adsorptiv jeweils aus der Gasphase an die Oberfläche übergeht oder sich wieder ablöst.
Auf die mathematischen Zusammenhänge werde ich hier nicht eingehen (es sei denn, Sie wollen es so), aber vereinfacht sind die folgenden Grenzfälle denkbar:
- Das Gleichgewicht liegt ganz rechts, das bedeutet, solange noch ein freier Adsorptionsplatz da ist, wird er belegt, und dann passiert nichts mehr, das Adsorptiv fließt durch. In diesem Idealfall, der nicht einmal bei Chemisorption so zu finden ist, wäre die Durchbruchkurve eine vertikale Stufe. Schon durch die Rückvermischung in der Schüttung wird sich jedoch eine mehr oder weniger abgerundete Durchbruchkurve ergeben.
- Das Gleichgewicht liegt ganz links, das heißt, es findet gar keine Adsorption statt. Hier findet der Durchbruch statt, sobald die Luft aus dem Zwischenkorvolumen verdrängt wurde, ebenfalls durch die Rückvermischung leicht verteilt.
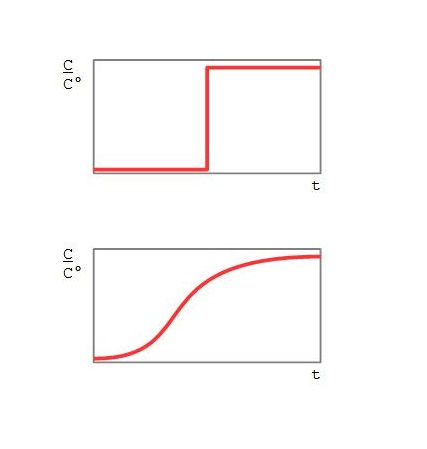
Abb. 3: Zwei idealisierte Durchbruchkurven
- Das Gleichgewicht liegt zwischen diesen beiden Zuständen – je mehr Adsorptionsplätze schon belegt sind, wenn ein „Fluidpäckchen“ mit einer Menge Adsorptiv darin mit dem Adsorbens in Berührung kommt, desto weniger wird noch zusätzlich adsorbiert. Dies führt zu den bekannten S-förmigen, symmetrischen Durchbruchkurven, die überall abgebildet werden.
Im Idealfall ist eine S-förmige Durchbruchkurve perfekt um ihren Mittelpunkt symmetrisch, der dort liegt, wo bei stufenförmiger Durchbruchkurve die Stufe läge. Im Realfall wird nicht nur die Dispersion mit der Länge des Adsorbers immer ausgeprägter werden, auch die Lage des chemischen Gleichgewichtes wird sich mit zunehmender Adsorption verändern, weil es nicht nur eine Art von Adsorptionsplätzen gibt. Beides führt zu einer Asymmetrie der Durchbruchkurven.
- Je weiter das Gleichgewicht rechts liegt – also je exenthalpischer die Adsorption – desto steiler wird die Durchbruchkurve.
- Die Kinetik spielt ebenfalls eine Rolle: Je schneller ein Adsorptionsvorgang stattfindet, desto steiler wird die Durchbruchkurve.
Coadsorption
Was geschieht nun, wenn nicht nur ein, sondern zwei Adsorptive um die Adsorptionsplätze konkurrieren? Das ist nicht nur bei Lösemittelgemischen der Fall, sondern auch Wasser ist oft vorhanden und kann ein zweites, mehr oder weniger konkurrenzfähiges Adsorptiv sein.
![Coadsorptionsverhalten mit geringer gegenseitiger Beeinflussung, errechnete Kurven, aus [2]](http://www.arnold-chemie.de/wp2016/wp-content/uploads/2016/07/Gu-20153.jpg)
Abb. 4: Coadsorptionsverhalten mit geringer gegenseitiger Beeinflussung, errechnete Kurven, aus [2]
- Im einfachsten Fall konkurrieren die beiden Adsorptive um die Adsorptionsplätze, ohne sich zu beeinflussen, wenn sie erst einmal adsorbiert sind. Dies ist der Fall bei sehr ähnlichen Adsorptiven, die sich in ihrem Adsorptionsverhalten wenig unterscheiden. Der Durchbruch kommt dann einfach entsprechend früher, als das bei den jeweiligen Einstoff-Durchbruchkurven der Fall wäre. In Abb.4 (eine simulierte Kurve) ist ein solches Verhalten zu sehen, allerdings wird auch hier die Durchbruchkurve der zuerst durchbrechenden Komponente schon aufgesteilt, was schon den Beginn des roll-up-Phänomens darstellt.
- Gewöhnlich hat man es jedoch mit zwei Adsorptiven mit deutlich unterschiedlichem Adsorptionsverhalten zu tun: Einer der beiden Adsorptive adsorbiert bei gleichem Partialdruck in der Gasphase (bzw. Konzentration in der flüssigen Phase) deutlich stärker als der andere. Ein gutes Beispiel hierfür ist die Adsorption von Stickstoff und Sauerstoff am Zeolithen LiX (siehe Abb. 5): Zunächst werden beide Komponenten adsorbieren, aber ein Stickstoffmolekül, welches auf einen mit Sauerstoff besetzten Adsorptionsplatz trifft, wird einen Teil der Sauerstoffmoleküle verdrängen und sich selbst dort niederlassen. Die desorbierten Sauerstoffmoleküle gesellen sich zu den Sauerstoffmolekülen, die schon in der Gasphase sind, und erhöhen ihre Konzentration. Auf den nächsten freien Plätzen adsorbieren sie, entsprechend ihrer Isotherme, mit einer höheren Beladung. Werden sie von diesen Plätzen wiederum vom Stickstoff verdrängt, erreicht ihre Konzentration in der Gasphase nochmals höhere Werte. Auf diese Weise wird eine Sauerstoffwelle mit stetig steigender Konzentration durch den Adsorber getrieben, und die Sauerstoffkonzentration am Austritt ist höher als die im Feedstrom. In Abb. 6 ist ein solcher Konzentrationspeak (wiederum für die flüssige Phase berechnet) dargestellt.
![Adsorptionsisothermen von Stickstoff und Sauerstoff auf LiX [3]](http://www.arnold-chemie.de/wp2016/wp-content/uploads/2016/07/BASF-7.gif)
Abb. 5: Adsorptionsisothermen von Stickstoff und Sauerstoff auf LiX [3]
![Abb. 6: Konzentrationspeak durch Verdrängungsdesoprtion [2]](http://www.arnold-chemie.de/wp2016/wp-content/uploads/2016/07/Gu-20152.jpg)
Abb. 6: Konzentrationspeak durch Verdrängungsdesorption [2]
Temperatureffekte
Einen Sonderfall stellen Systeme dar, in denen eine Komponente eine deutliche Temperaturerhöhung bei der Adsorption aufweist. Ein solcher Fall ist etwa die Adsorption von CO2 und Wasser auf Zeolith 5A. Da die Temperaturabhängigkeit der Adsorption bei einem Adsorptiv deutlich ausgeprägter ist als beim anderen, wird das flüchtigere Adsorptiv nicht nur durch Verdrängungsdesorption, sondern auch durch thermische Desorption ausgetrieben. Da je nach Massenverhältnissen die Wärmewelle der Adsorptionsfront vorauseilen oder hinterherhinken kann, werden die Verhältnisse hier sehr schnell undurchsichtig.
Ein besonderes Beispiel ist die Adsorption von Wasser und CH2Cl2 auf Envisorb B+: Dieses Adsorbens ist eine Mischung aus Aktivkohle und Silicagel. Da die Aktivkohle das Methylenchlorid wesentlich stärker adsorbiert als das Wasser, und der Silicagel-Anteil sich genau umgekehrt verhält, sollte man erwarten, dass die beiden Stoffe in voneinander getrennten „Kompartimenten“ adsorbieren und sich nicht gegenseitig beeinflussen. Trotzdem kommt es hier zu einem, wenn auch nur kleinen, roll-up: Dies ist vermutlich der ausgeprägten Wärmeentwicklung der Wasseradsorption geschuldet, die Wärme wird an die Kohle weitergeleitet (siehe Abb. 7).
![Coadsorption von Wasser und Methylenchlorid an Envisorb B+ - Durchbruchkurven [5] (Klick für volle Größe)](http://www.arnold-chemie.de/wp2016/wp-content/uploads/2016/07/Envisorb-Coadsorption-300x187.jpg)
Abb. 7: Coadsorption von Wasser und Methylenchlorid an Envisorb B+ – Durchbruchkurven [4] (Klick für volle Größe)
[1] Kim, J. H., Ma, X., Zhou, A., & Song, C. (2006). Ultra-deep desulfurization and denitrogenation of diesel fuel by selective adsorption over three different adsorbents: A study on adsorptive selectivity and mechanism. Catalysis Today, 111(1-2), 74–83. http://doi.org/10.1016/j.cattod.2005.10.017
[2] Gu, T. (2015). Interference Effects in Multicomponent Chromatography, 6.2: Computer Simulation and Discussion. In Mathematical Modeling and Scale-Up of Liquid Chromatography (2nd. ed., p. 64 ff). Springer New York. (Seite auf Google Books). Bei allen Kurven aus dieser Quelle wurde die Zeitachse so angepasst, dass die Durchbruchkurve des Einstoff- und des Mehrstoffsystems zusammenfallen. Die Kurve des Einstoffsystems ist also so zu verstehen, als wäre entsprechend weniger Adsorbens vorhanden.
[3] Aus einer Online-Produktpräsentation der BASF SE, 2011.
[4] Messdaten der Engelhard Process Chemicals GmbH, ca. 2005.
Schreibe einen Kommentar