Im vorletzten Blogbeitrag haben wir uns angeschaut, was man mit Hägg-Diagrammen machen kann. In aller Kürze kann man bei Säuren oder Basen erkennen, welche der Spezies man bei welchem pH in welcher Konzentration vorliegen hat. Das bekannteste Beispiel ist das Carbonatsystem des Meerwassers.
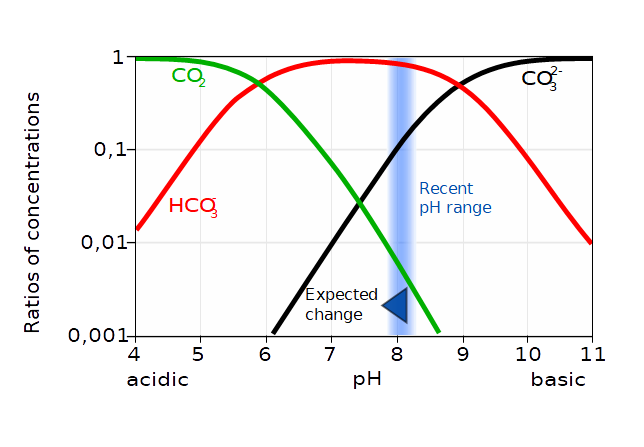
Da die freie Kohlensäure H2CO3 nur in geringster Menge vorhanden ist, wird dieser Teil als CO2 ausgedrückt, bedeutet aber die Summe von H2CO3 und CO2. Die Konzentration von CO2 im Meerwasser hängt nun nicht allein vom pH ab, sondern auch von der Konzentration von CO2 in der Atmosphäre über der Wasseroberfläche: Je mehr CO2 dort vorhanden ist, desto mehr löst sich im Wasser und desto saurer wird das Wasser auch.
Man kann hier gut erkennen, dass schon ein minimaler Abfall des pH zu einer relevanten Konzentrationsverminderung von CO32- im Seewasser führen wird (die y-Achse ist logarithmisch!). Das Carbonatanion CO32- brauchen aber Korallen und Schalentiere, um ihre Kalkskelette aufzubauen. Über die Folgen der sogenannten Versauerung der Ozeane haben andere schon ausführlich geschrieben. Hier ist z. B. ein allgemeinverständlicher Artikel vom GEOMAR Helmholtz-Zentrum für Ozeanforschung in Kiel.
In der Umweltverfahrenstechnik brauchen wir die Hägg-Diagramme vor allem, um das Verhalten von flüchtigen Säuren und Basen in wässriger Lösung zu beurteilen: Werden sie strippen? Werden sie Salze bilden?
Quellen für Hägg-Diagramme
Tabellenkalkulation oder Funktionenplotter
Man kann Hägg-Diagramme grundsätzlich mit jedem Funktionen- oder Datenplotter erstellen, ich habe Excel dazu verwendet. Die Herleitung ist allerdings nicht ganz einfach. Für das Carbonatsystem ist sie auf Wikipedia erklärt. Wenn man die jeweiligen K-Werte einsetzt, lassen sich die Formeln auch für jede andere zweibasige Säure, etwa Schwefelwasserstoff, anwenden. Meine eigene Umsetzung für zweibasige Säuren ist hier zum Download, die eingesetzten Formeln sind auch zu sehen.
Literaturrecherche
Wegen der vielen Synonyme für das Hägg-Diagramm habe ich die fast vergessene Suchsyntax verwendet, die z. B. in diesem Google-Cheatsheet aufgelistet ist. Erst wenn diese Suche nur Schrott zutage fördert, würde ich mich an eine wissenschaftliche Literaturdatenbank wenden.
Meine Suchanfrage lautete („hägg diagramm“ OR „bjerrum plot“ OR „hägg’s diagram“) (H2S OR „hydrogen sulfide“). Ich finde dort z. B. eine Klausur aus dem Studiengang Chemieingenieurwesen der FH Münster. Das ist mir zunächst vertrauenswürdig genug, und ich finde zwei Diagramme in unterschiedlicher Darstellungsweise, logarithmisch und linear.
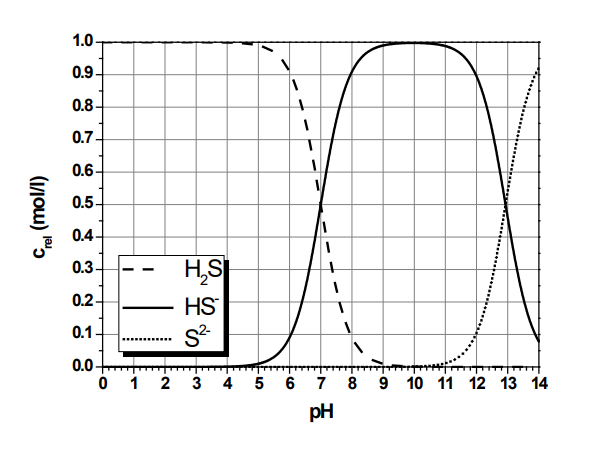
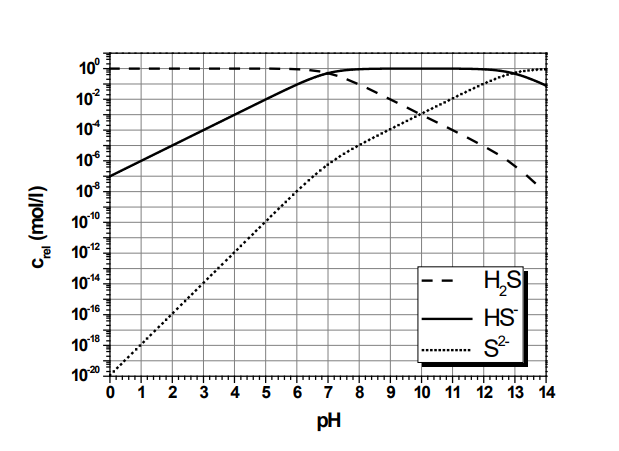
Hier fällt mir ein Punkt auf: Die Konzentration von H2S in Wasser ist dort, wo H2S die dominierende Spezies ist. mit 100 mol/l bzw. 1 mol/l = 34,08 g/l angegeben. Gleichzeitig ist die maximale Löslichkeit von H2S in Wasser bei 20 °C nur 4,13 g/l (diese Angaben stammen aus dem Merck Index 12th Edition, 1996, lassen sich aber in jedem Chemikalienkatalog oder Sicherheitsdatenblatt genauso finden). Andererseits ist die Konzentration angegeben als Crel, also als relative Konzentration oder Anteil am Ganzen. Den darf man nicht als mol/l angeben, denn er ist dimensionslos.
Wenn wir bereit sind, diese Ungenauigkeit zu verzeihen, können wir noch einen weiteren Punkt prüfen: An den beiden Schnittpunkten zwischen [H2A] und [HA–] sowie [HA–] und [A2-], also hier [H2S] und [HS–] sowie [HS–] und [S2-] entspricht der pH dem pKA1 und pKA2. Diese Werte (die im Deutschen oft als pKS-Werte bezeichnet werden) lassen sich z. B. auf Wikipedia finden. pKA1 liegt bei 7, das stimmt also. pKA2 ist so schwierig zu messen, dass die Angaben, die man findet, zwischen 13 und 17 angesiedelt sind. „Nichts Genaueres weiß man nicht.“ Wir können uns mit dem Fund begnügen.
Titrationssimulator
Eigentlich wollte ich an dieser Stelle die Freeware „HySS“ vorstellen, fand aber, dass sie zu oft abstürzt. Vier bis fünf Versuche pro Diagramm, bis es klappt, und dazu eine spärliche Dokumentation und undurchsichtige Programmoberfläche haben mich letztlich vergrault. Statt dessen möchte ich das wesentlich transparentere „CurTiPot“ empfehlen, welches nichts als eine Excel-Datei mit einigen Makros ist.
Man erhält zwei Dateien, curtipot_.xlsm (zum Benutzen) und curtipot_i.xlsm (zum Lernen). Beide sind gleich, nur dass curtipot_i ausführlichst mit Kommentaren dekoriert ist und curtipot_ nicht. Es sind verschiedene Blätter vorhanden, ein pH-Rechner, ein Titrationssimulator und auch ein Generator von Hägg-Diagrammen, der „Distribution“ genannt wird. Wenn man sich durch die durchnummerierten Kommentare durcharbeitet, kommt man leicht zum Ziel. Im Grunde muss man nur die entsprechende Säure oder Lauge aus einer Liste auswählen (Zelle D3) und die Anfangskonzentration eingeben (C9). Und so sieht das Ergebnis aus.
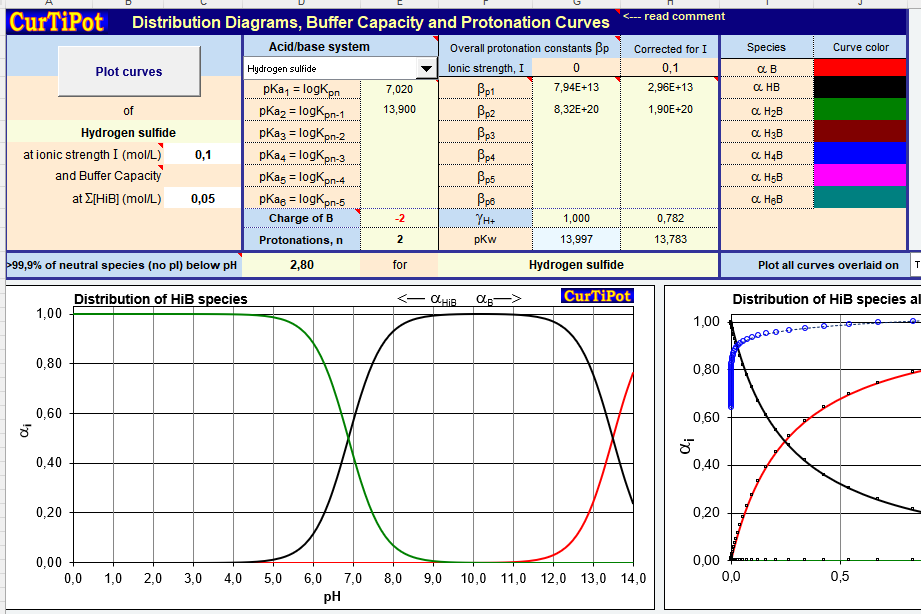
Wenn Sie sich tatsächlich bis hierher durchgebissen haben, gratuliere ich. Sollten Sie gelegentlich mit wässrigen Lösungen zu tun haben, werden Sie CurTiPot sicher nützlich finden, auch zur Berechnung von Neutralisationen, den pH-Werten von Gemischen etc. Und wenn es doch irgendwo haken sollte – schreiben Sie mir!
Schreibe einen Kommentar