Schlaumeier hat zwei Abluftströme: Einen mit Ammoniak, und einen anderen mit Schwefelwasserstoff. „Prima“, sagt er sich, „bringen wir sie doch zusammen und binden so beide übelriechende Gase.“
Klar, Säure (H2S) plus Base (NH3) gibt Salz (Ammoniumsulfid (NH4)2S oder Ammoniumhydrogensulfid NH4HS) plus Wasser – aber kann das z. B. in einem Wäscher wirklich so stattfinden? Und bei welchem pH-Wert?
Einen ersten, vereinfachten Eindruck davon liefert das Hägg-Diagram, auch Bjerrum-Plot, Hägg’s diagram, Sillén diagramm oder Speziierungsdiagramm genannt.
Das Diagramm
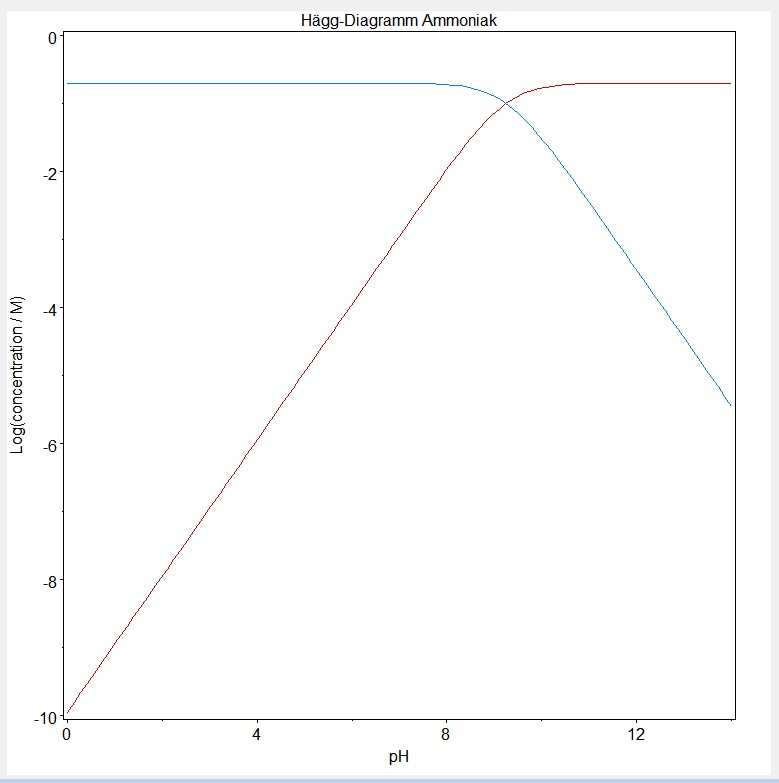
In der ersten Abbildung ist das Hägg-Diagramm für Ammoniak zu sehen.
Die Grundlagen
Wir müssen leider ein paar chemische Formeln betrachten. Zunächst einmal die Umsetzung, die Schlaumeier erreichen möchte:
2 NH3 + H2S ⇆ 2 NH4+ + S2-
Das bedeutet, er muss in einem pH-Bereich arbeiten, in welchem NH4+ die vorherrschende Form ist. Liest man auf der x-Achse den pH-Wert ab, kann man auf der y-Achse die Konzentrationen der jeweiligen Spezies, meistens mehr als eine, ablesen. Hier handelt es sich selbstverständlich um Ammoniak NH3 und Ammonium NH4+.
Bei pH = 9,25 ergibt sich laut dem Diagramm, dass die Konzentration [NH4+] gleich der Konzentration [NH3] ist. Das ist der Kreuzungspunkt der beiden Linien. Gut wäre es, unterhalb von pH = 8 zu bleiben, damit keine merklichen Mengen Ammoniak mehr vorhanden sind.
Natürlich muss auch H2S vorwiegend als S2- vorliegen. Dessen Hägg-Diagramm finden wir nach einiger Recherche in der Chemischen Literatur (Abb. 2) [1]:
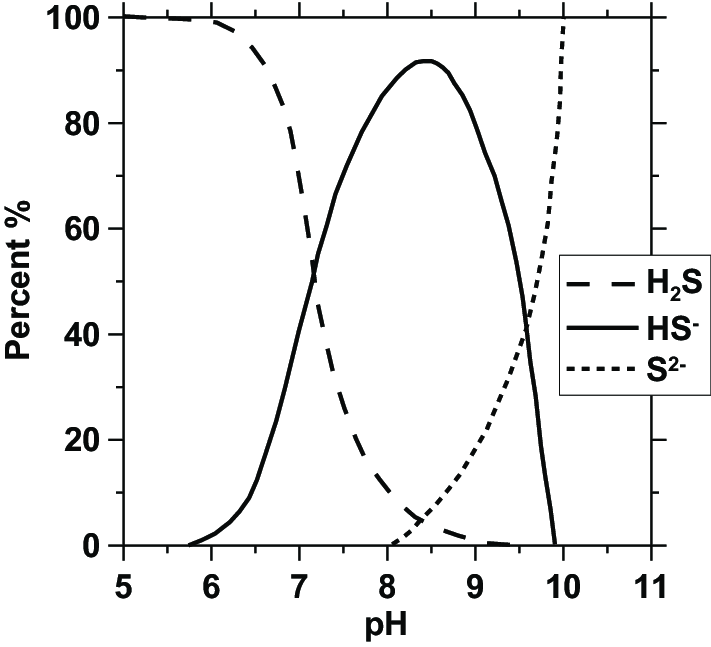
Man beachte, dass die y-Achse hier eine andere ist: Nicht absolute Konzentration, sondern die prozentualen Anteile der jeweiligen Ionensorte an der Gesamtmenge ist angegeben. Auch ist die Skala nicht logarithmisch wie sonst üblich. Für eine erste Beurteilung macht das allerdings keinen Unterschied.
Wenn S2- die überwiegende Spezies sein soll, muss Schlaumeier bei pH ⪖ 10 arbeiten. Nur leider hat er bei so alkalischem pH keine nennenswerten Mengen NH4+ mehr vorliegen.
So antiintuitiv es erscheint, wird die vollständige Neutralisation von Ammoniak und Schwefelwasserstoff nicht stattfinden, weil es keinen pH gibt, bei dem sie stattfinden könnte. Allenfalls könnte man bei pH ≅ 8 die Umsetzung zu Ammoniumhydrogensulfid erreichen:
NH3 + H2S ⇆ NH4+ + HS–
Allerdings hat man hier noch ca. 10% des Schwefelwasserstoffs als freies H2S vorliegen, und somit wahrscheinlich immer noch ein Geruchsproblem. Schlaumeiers Idee lässt sich somit nicht umsetzen.
Wie wär’s mit Schwefelsäure?
Ammoniak ist ein wertvoller Rohstoff, kann man ihn vielleicht mit einer anderen Säure binden? Vielleicht mit Schwefelsäure H2SO4 als Ammoniumsulfat, welches sich, wie Schlaumeier weiß, verkaufen lässt. Die Reaktion lautet
2 NH3 + H2SO4 ⇆ (NH4)2SO42-
Das Hägg-Diagramm von Schwefelsäure wurde mit meiner lieblings-eierlegenden Wollmilchsau Excel erstellt. Hierfür muss man lediglich die beiden pKA-Werte kennen. Man findet sie z. B. auf Wikipedia.
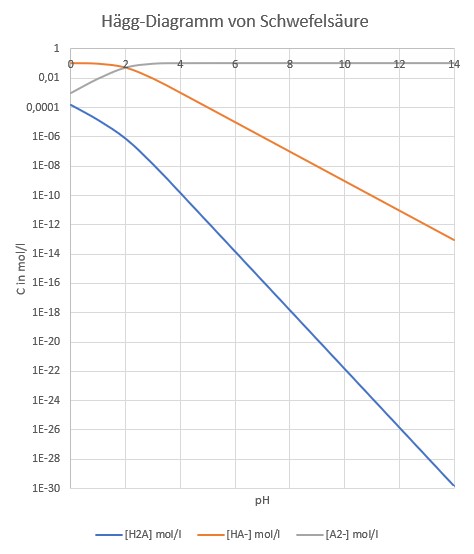
Schlaumeier braucht die „graue Spezies“, nämlich SO42-. Ab pH = 5 ist er ziemlich auf der sicheren Seite, weil dann SO42- über 99% der anwesenden Spezies ausmacht. Um ausreichend Ammoniumionen zu haben, muss er, wie wir vorher gesehen haben, unter pH = 8 bleiben. Hier hat er also den Bereich zwischen pH 5 bis 8 zur Verfügung. Da er das (ausgezeichnet wasserlösliche) Ammoniumsulfat etwa durch Pervaporation einengen muss, ehe es in fester Form vorliegt, sollte er eher bei pH = 5 als pH = 8 arbeiten, weil dann die Zersetzung von Ammonium mit Wasser zu (flüchtigem) Ammoniak und Hydroniumionen, die sogenannte Hydrolyse, geringer ist. (Die Gleichung lautet NH4+ + H2O ⇆ NH3 + H3O+.)
Tools
Ich habe die hier verwendeten Diagramme aus drei Quellen beschafft: Literaturrecherche, die Freeware „HySS“, und ein selbstprogrammiertes Excel-Tool.
Im nächsten Beitrag gehen wir auf diese drei Datenquellen und den Umgang mit ihnen genauer ein.
[1] House, Mitchell & Weiss, William. (2014). Review of Microbially Induced Corrosion and Comments on Needs Related to Testing Procedures. Proceedings of the 4th International Conference on the Durability of Concrete Structures, ICDCS 2014. 94-103. 10.5703/1288284315388. (Volltext auf Researchgate)
[…] vorletzten Blogbeitrag haben wir uns angeschaut, was man mit Hägg-Diagrammen machen kann. In aller Kürze kann man bei Säuren oder Basen erkennen, welche der Spezies man bei welchem pH in […]