In Produktion und Umwelttechnik hat man es öfter mit Mischungen als mit reinen Flüssigkeiten zu tun. Man möchte etwa vorhersagen, wie stark die überstehende Gasphase eines Wäschersumpfs oder einer Kondensatfalle beladen sein wird, ob es zu UEG-Überschreitungen etc. kommen kann.
Leider sind die Dampfdrücke einer Mischung viel schwieriger zu berechnen als die Dampfdrücke reiner Stoffe. Gute Chancen, den Dampfdruck einer Komponente in einer Mischung zu berechnen, hat man eigentlich nur bei binären, bestenfalls noch ternären Mischungen. Das schränkt die Verwendbarkeit der Berechnungen ein auf Fälle wie
- definierte, einfache Formulierungen, z. B. ein wasserhaltiges Lösungsmittel
- Kreislaufwasser aus Wäschern für nur eine Abluftkomponente
- definierte Lösemittelmischungen.
Medien wie etwa das Kreislaufwasser eines Abluftwäschers, der bis zu zwanzig Lösungsmittel abscheiden muss, oder der Kondensatsammler einer Lösemittelrückgewinnung aus Abluft sind dagegen hoffnungslose Fälle, die man höchstens statistisch angehen kann.
Neben der Komplexität von Mischungen macht vor allem nicht-ideales Verhalten die Aufgabe, Dampfdrücke vorauszuberechnen, schwierig.
Sehen Sie zunächst als Beispiel für ideales Verhalten das Mischungsdampfdruck-Diagramm einer idealen Mischung, Styrol und Benzol.
Ideales Verhalten, Raoult’sches Gesetz
Wir rechnen einfach mit dem Dampfdruck der flüchtigsten Komponente, schlimmer kann es doch nicht kommen, oder?
Das stimmt nur bei idealem Verhalten der Mischung. „Ideales Verhalten“ bedeutet in diesem Fall, dass der Dampfdruck einer Komponente proportional zu ihrem Stoffmengenanteil in der Mischung ist. Kurz und knapp ist dieser Zusammenhang, das Raoult’sche Gesetz, in Chemgapedia erläutert. Das Diagramm zeigt die Dampfdrücke der Einzelkomponenten und den Dampfdruck der Gesamtmischung als Funktion der Zusammensetzung, hier bei 20 °C.

Raoult’sches Gesetz, Abschätzung von Mischungsdampfdrücken über die Stoffmengenanteile
Der Stoffmengenanteil X ist der „molare Prozentanteil“ – um von diesem auf den Massenanteil zu kommen, benötigt man die molaren Massen Mw beider Stoffe, MwToluol = 92,14 g/mol und MwBenzol = 68,11 g/mol.
Der Massenanteil y von Toluol wird berechnet nach
yToluol = XToluol * MwToluol/(XToluol * MwToluol + XBenzol * MwBenzol)
Dies ist der eher seltene Fall einer idealen Mischung. Die Komponenten sind in jedem Verhältnis miteinander mischbar, beeinflussen sich jedoch gegenseitig nicht. Beispiele wären Mischungen linearer Kohlenwasserstoffe oder anderer ähnlicher, sich gegenseitig nicht beeinflussender Stoffe.
Der Dampfdruck der Mischung ist in diesem Fall tatsächlich niemals höher als der der flüchtigeren Komponente Benzol, sondern tatsächlich deutlich niedriger – sicher, aber nicht ideal, wenn man Komponenten auf dieser Basis auslegt.
Nicht-ideale Mischungen
Im Diagramm unten sind die Dampfdrücke des Systems Kohlenstoffdisulfid (CS2, „Schwefelkohlenstoff“) und Aceton dargestellt. [1]
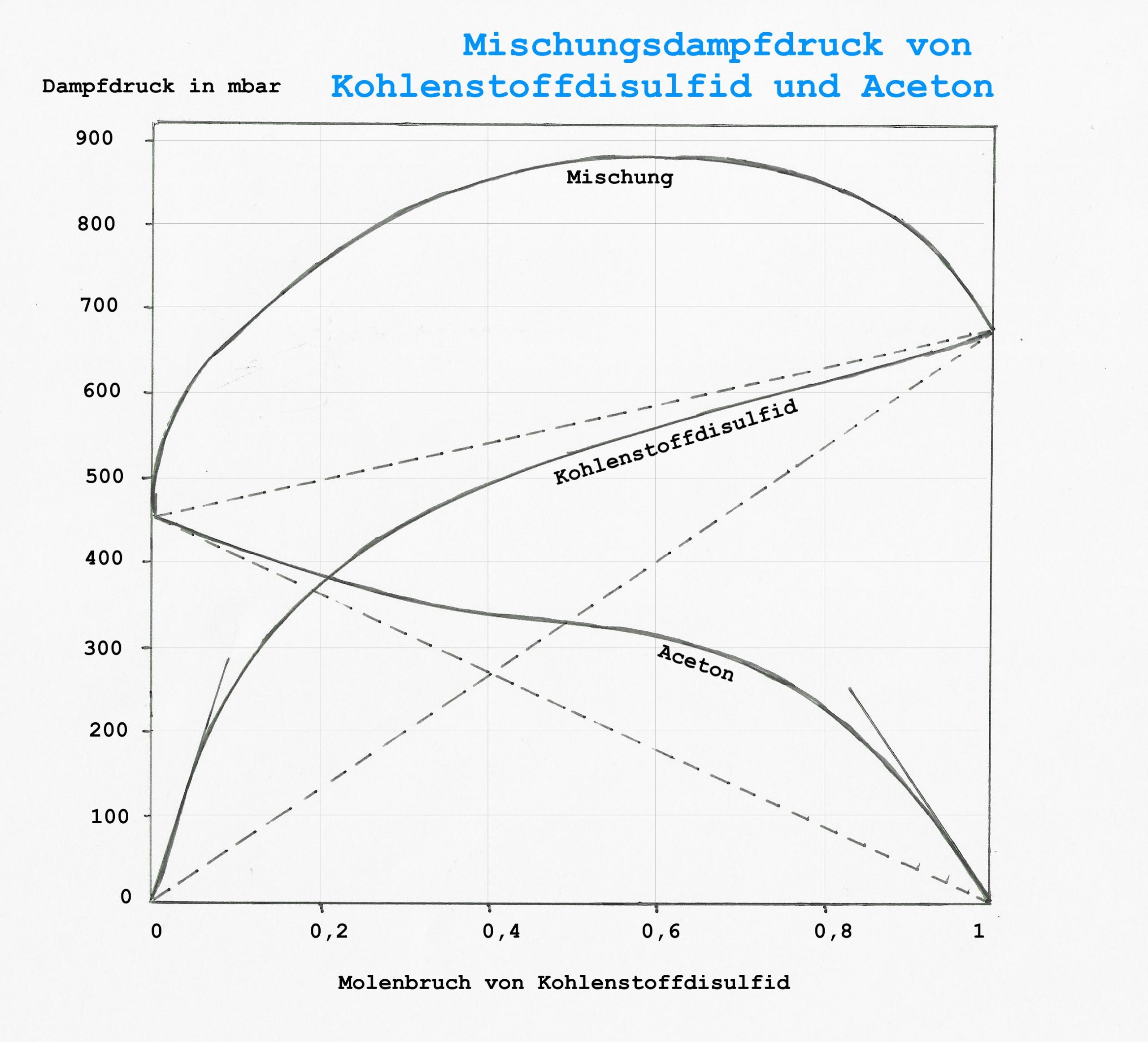
Dampfdruck der Mischung von Kohlenstoffdisulfid und Aceton bei 20 °C, Einzelkomponenten und Gesamtdruck der Mischung
Man beachte, dass die Mischung in gewissen Bereichen einen Dampfdruck hat, der über dem der Einzelkomponenten liegt. Die gestrichelten Linien deuten ideales Verhalten an. Die kleinen Geraden, die bei reinem Kohlenstoffdisulfid und Aceton beginnen, zeigen, dass es einen kurzen Bereich linearer Proportion gibt, allerdings mit einem Proportionalitätsfaktor, den man kennen muss.
Henry-Gesetz
Auch für solche Mischungen lässt sich der Dampfdruck einer Komponente noch berechnen, zumindest für die kleinen linearen Bereiche, in denen der gelöste Stoff in sehr kleiner Menge in der Lösung vorliegt, wie für Kohlenstoffdisulfid in Aceton (linke Teilgerade) oder umgekehrt Aceton in Kohlenstoffdisulfid. Für den kleinen Bereich kann ein linearer Zusammenhang zwischen Konzentration einer Komponente und ihrem Partialdruck in der Gasphase angenommen werden, nur ist der Proportionalitätsfaktor nicht mehr der Dampfdruck des Reinstoffes, sondern die Henry-Konstante.
Das Henry-Gesetz lautet
p = k * c
mit p = Partialdruck, c = Konzentration, und der Henry-Konstante k. In SI-Einheiten hat k die Einheit Pa * m³/mol, wird aber leider oft noch in Einheiten wie l * atm/mol angegeben, und manchmal sogar als ihrem Kehrwert, der Fugazität. Die meisten Henry-Konstanten in der Literatur beziehen sich auf wässrige Lösungen.
Gerne wird versucht, das Henry-Gesetz zur Auslegung von Wäschern zu verwenden, indem vom Grenzwert in der Gasphase auf die zulässige Konzentration der Waschflüssigkeit zurückgeschlossen wird. Das kann funktionieren, wenn diese Konzentration sehr klein ist, und vor allem weit von einer Mischungslücke entfernt, da in der Nähe von Mischungslücken der Dampfdruck der Komponente überproportional stark ansteigt.
Weiterlesen
- Chemguide über nichtideale Mischungen
- Eine ausführlichere Erläuterung des Zweistoffsystems „Dampf – Flüssigkeit“
- Wikipedia über das Henry-Gesetz und die verschiedenen Formen, in denen es ausgedrückt wird (unglaublich, wie kompliziert eine Formel mit drei Variablen gemacht werden kann …)
- Henry-Konstanten – die klassische Sammlung von Rolf Sander
- „Estimate Emissions from Depressurization Activities“ (Abschätzung von Emissionen beim Druckausgleich von Flüssigkeitsbehältern) – dieser Artikel aus der AIChE-Zeitschrift „Chemical Engineering Progress“ war 2005 eine Zeitlang frei zugänglich. Posten möchte ich ihn nicht, aber wenn Sie mir schreiben, maile ich Ihnen den Artikel gerne zu.
- Der Unterschied zwischen chemischen und physikalischen Eigenschaften ist beim Erstellen von Mischungen äußerst wichtig: Eine Erläuterung der Begriffe.
[1] Daten aus Christen, „Grundlagen der allgemeinen und anorganischen Chemie“, ISBN 3-7935-5394-9
Schreibe einen Kommentar