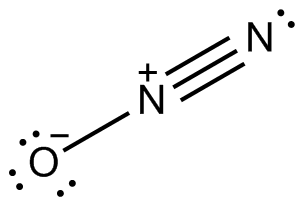
Distickstoffmonoxid, oder Lachgas: Lewis-Formel
Distickstoffmonoxid, N2O, mit Trivialnamen Lachgas, ist seit einigen Jahren als Klima- und Ozonkiller bekannt. Als solches bekannt ist das farblose, relativ stabile, süßlich riechende Gas schon seit Mitte des 19. Jahrhunderts. Durch seine schmerzlindernden, betäubenden Eigenschaften wurde es (und wird in geringerem Umfang immer noch) als Narkosegas eingesetzt.
Wie es den Trivialnamen „Lachgas“ bekommen hat, ist nicht ganz klar, den man beginnt nach dem Inhalieren keineswegs schallend zu lachen. Es wirkt leicht berauschend und verwirrend und hat deswegen in manchen Kreisen auch als Partydroge seinen Auftritt.
Seine Bedeutung als Klimakiller ist, wie so vieles andere, indirekt der Überbevölkerung geschuldet.
Woher kommt das Distickstoffmonoxid?
In der Natur ist N2O ein Nebenprodukt der Nitrifikation und Denitrifikation, läuft also überall dort ab, wo Böden Stickstoffverbindungen enthalten – sprich, auf gedüngten Flächen. Auch intensive Tierhaltung trägt zu den Emissionen bei. Teilweise bildet sich die Verbindung auch spontan in der Natur, auf katalytisch aktiven Oberflächen, das spielt aber nur eine minimale Rolle.
Weitere anthropogene (vom Menschen verursachte) Emissionen kommen aus Verbrennungprozessen: Wenn man die Emission höherer Stickoxide, etwa NO2, reduziert, erhöht man damit im Gegenzug die Emission von Distickstoffmonoxid. Außerdem ist N2O auch ein Nebenprodukt bestimmter chemischer Emissionsprozesse.
Die Quellen hat die EPA in einem Diagramm zusammengestellt: Zumindest in den USA stammen 74% der Emissionen aus der Landwirtschaft.
Verwendung
- „Lachgas“ wird immer noch als Narkosegas verwendet, wenn es auch nach und nach von anderen Gasen verdrängt wird.
- Da es gut fettlöslich ist, verwendet man es in Sahnespendern zum Aufschlagen von Sahne (und diese Kapseln sind auch die Quelle für Lachgas als Partydroge, da man sie frei kaufen kann).
- Distickstoffmonoxid brennt nicht, aber es fördert die Verbrennung. Es enthält zweieinhalb man so viel Sauerstoff pro Volumeneinheit wie Luft, und dieser Sauerstoff fällt beim Zerfall von N2O in einer aktiveren Form an. Daher kann man die Leistung von Verbrennungsmotoren um ca. 70% steigern, wenn man sie mit N2O statt mit Luft laufen lässt. Das Gas lässt sich ohne Kühlung verflüssigen und daher leicht mit dem Fahrzeug mitführen. Hierzulande gibt es dafür allerdings keine Straßenverkehrszulassung. N2O unterstützt nur Verbrennungsprozesse, nicht die Atmung (es zerfällt nicht bei Raum- oder Körpertemperatur), daher sollte man nicht versuchen, etwa seine Leistungen beim Sportabzeichen damit zu steigern.
N2O als Klimakiller
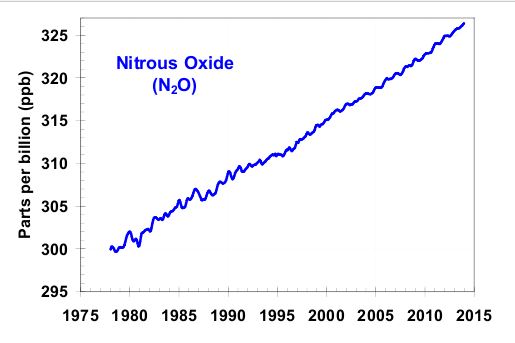
Distickstoffmonoxid hat mittlerweile eine Atmosphärenkonzentration von 325 ppb erreicht, das ist etwa 1/1000 der Konzentration an Kohlendioxid. Der Treibhauseffekt von N2O ist aber ca. 300 mal höher als der von Kohlendioxid. Neben den anderen Treibhausgasen ist N2O für ca. 5 – 6% des Treibhauseffektes zuständig (lt. EPA).
Distickstoffmonoxid trägt auch zur Zerstörung der Ozonschicht bei. Zwar nicht direkt, aber es reagiert mit Sauerstoff zu NO, und dieses fördert den Zerfall von Ozon.
Ist es schädlich für die Gesundheit der Menschen?
Lange Zeit dachte man, außer dem Narkoseeffekt hätte Lachgas keine negativen gesundheitlichen Auswirkungen. Das hat man mittlerweile revidieren müssen: Bei Personen, die berufsmäßig erhöhten Konzentrationen ausgesetzt sind (etwa in schlecht gelüfteten Operationsräumen), hat man eine Reihe von immunologischen Problemen feststellen können, außerdem eine erhöhte Rate von Fehlgeburten. Mehr Informationen gibt es auf den folgenden Seiten und Publikationen:
- EROWID – dies ist allerdings eine Seite, die den Konsum befürwortet oder zumindest gegen seine Bekämpfung ist, und „… die Wahrheit über psychoaktive Substanzen publizieren möchte“.
- Eine Präsentation für Zahnärzte, die die Verbindung als Narkosemittel einsetzen
- „Health hazards and nitrous oxide: A time for reappraisal.“ J. A. Yagiela, Anesth Prog. 1991 Jan-Feb; 38(1): 1–11. Dies ist ein im Volltext vorhandener Review, nicht mehr neu, aber ein guter Einstieg.
Beseitigung
Für gefasste Ströme aus Verbrennungen und der chemischen Industrie gibt es adsorptive und katalytische Methoden. Im Folgenden einige Beispiele:
- Adsorption an Naturzeolithen, etwa Mordeniten. Ein Teil der Adsorption ist irreversibel, die Kapazitäten nicht sehr hoch.
- Adsorption an Aktivkohlen: Eher noch ungünstiger, was daran liegt, dass Distickstoffmonoxid ein polares Molekül ist.
- Adsorption an TiO2 mit anschließender photokatalytischer Zersetzung: Dazu braucht man reduziertes Titandioxid, also mit weniger Sauerstoff als nach der Formel. Es muss ab und an wieder regeneriert werden.
- SCR (Selective Catalytic Reduction) mit Methan als Reduktionsmittel: Zwar wird pro abgebautem Molekül N2O 0,5 Moleküle CO2 frei, aber da das Treibhauspotenzial des N2O ca. 300 mal höher ist als das des CO2, bringt das Verfahren trotzdem eine Verbesserung.
- SCR-Variante mit Ammoniak als Reduktionsmittel: Dabei wird zwar kein CO2 mehr freigesetzt, aber Ammoniak ist energieaufwändiger herzustellen als Methan.
Es gibt demnach einige Methoden, Distickstoffmonoxid aus der Luft zu entfernen, das Problem ist jedoch, dass nur ein kleiner Teil in gefassten Abluftströmen anfällt. Der größte Teil steigt diffus von landwirtschaftlichen Flächen auf, wo der einzige Lösungsansatz wäre, die Ausbringung von Stickstoff insgesamt zu verringern. Vielleicht würde es auch helfen, den Stickstoff in eine schlechter lösliche Form zu bringen, damit die Nitrifikations-Denitrifikationskaskade eine Chance bekommt, mehr der Stickstoffverbindungen zu elementarem Stickstoff umzusetzen.

K.Hofsäss meint
Vielen Dank für den umfassenden Bericht zu N2O
Kann den NL nur empfehlen !
MfG
Hofsäss