Thermal Runaway – thermisches Durchgehen – beginnt meistens ganz unauffällig. Der Reaktionsapparat (das kann ein chemischer Reaktor oder auch ein Adsorber sein) ist ein paar Kelvin über dem Sollwert. Oft veranlasst das noch keine Reaktion der Bediener außer der Bemerkung: „Ach, das macht der öfter, das regelt sich von selbst wieder.“
Einmal kommt aber der Tag, an dem die Temperatur nicht wieder zurückgeht, sondern weiter steigt. Und steigt. Und steigt, obwohl man Korrekturversuche unternimmt. Wenn man nicht genau weiß, welche Maßnahme den Reaktionsapparat in so einer Situation abkühlen wird (und das ist manchmal antiintuitiv), läuft die Temperatur nach oben davon bis zum unausweichlichen Ausgang – Überdruck mit eventuell katastrophalen Folgen, oder ein Brand.
Das Montagsfeuer
Bei Adsorbern (Aktivkohle oder Zeolith) läuft ein Thermal Runaway häufig nach dem folgenden Muster ab: Der Adsorber wird am Freitagnachmittag abgeschaltet und vom Luftstrom abgeriegelt. Am Montag, wenn er wieder angefahren werden soll, stellt man fest, dass er unerwartet warm ist, etwa 60 – 80 °C statt Raumtemperatur. Dies ist allerdings keine sonderlich „hohe“ Temperatur. Also öffnet man die Klappen und beginnt, die Abluft durch den Adsorber zu blasen. Wahrscheinlich wird er sich dabei abkühlen. Es kann aber auch passieren, dass er sich stattdessen erwärmt, Temperaturen von 1.000 °C oder mehr erreicht und wenn nicht sich selbst und die Umgebung, so doch das Adsorbens zerstört.

Wie kann es zu dieser Selbsterwärmung mit oder ohne Selbstentzündung kommen – und das am Montag, bzw. nach einer Zeit, in der die Anlage stillgestanden hat?
Der Mechanismus
Generell kommt es zu einem thermischen Durchgehen, wenn bei einer Steigerung der Wärmeentwicklung die Kühlleistung nicht mithalten kann. Klassisch wird das mit dem Semenov-Diagramm illustriert.
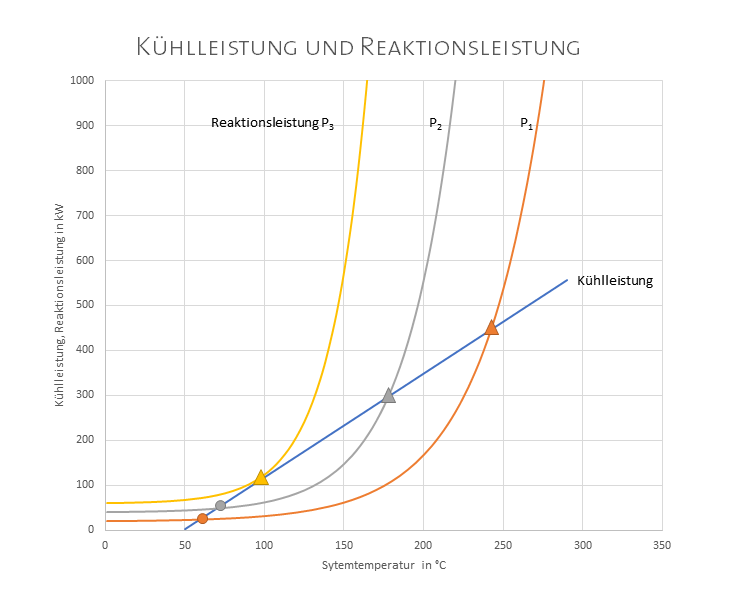
In diesem Diagramm werden die Wärmeleistung einer Reaktion und die Leistung des Kühlsystems als Funktion der Systemtemperatur einander gegenübergestellt.
- Die Kühlleistung hängt ab von der Temperaturdifferenz des Kühlmediums und des Systems, steigt also linear mit der Temperatur.
- Die Wärmeleistung der chemischen Reaktion hängt ab vom Arrhenius-Gesetz, steigt also exponentiell mit der Temperatur.
Das System bleibt bei konstanter Temperatur, solange Wärmezufuhr und Wärmeabfuhr gleich groß sind. Beim unteren Gleichgewichtspunkt (kreisförmige Symbole) verhält sich das System unkritisch: Steigt aus irgendeinem Grund die Wärmeleistung der Reaktion (etwa durch schwankende Konzentration im Zulauf), dann steigt die Kühlleistung stärker und drückt das System auf den Gleichgewichtspunkt zurück. Fällt die Temperatur unter die Gleichgewichtstemperatur, fällt die Heizleistung weniger ab als die Kühlleistung und die Temperatur wird wieder zum Gleichgewichtspunkt ansteigen.
Sollte irgend ein Zwischenfall die Temperatur bis auf den oberen Gleichgewichtspunkt befördern (dreieckige Symbole), wäre das System dort in einem labilen Gleichgewicht. Eine noch so geringe Temperaturerhöhung führt zu einer zusätzlichen Heizleistung, die vom Kühlsystem nicht mehr kompensiert werden kann, was die Temperatur und somit die Reaktionsgeschwindigkeit und somit die Heizleistung weiter steigert. Die Temperatur steigt vom oberen Gleichgewichtspunkt an ungebremst an. Das ist der sogenannte Thermal Runaway.
Es ist leicht zu erkennen, dass die Reaktion mit der Leistung P3 keinen stabilen Betriebspunkt mehr hat, weil das Kühlsystem zu schwach ist.
Das Besondere bei Adsorbern
Der oben beschriebene Mechanismus ist universell, er gilt also zum Beispiel auch in einem Rührkesselreaktor. Idealerweise ist in einem solchen Reaktor das Medium so gut durchmischt, dass die Temperatur überall gleich ist.
Dies gilt nicht für Adsorber für die Gasphase, die mit einem gekörnten Adsorbens gefüllt sind:
- Die Wärmeleitung der Packung ist extrem schlecht – nur eine Größenordnung besser als die von Luft [1] – und die Körner berühren sich nur an einzelnen Punkten. Eine Wärmeleitung durch die Packung kann in der Praxis vernachlässigt werden.
- Wärmeabfuhr findet somit größtenteils durch den Gasstrom statt, der die Packung durchströmt. Wenn der Gasstrom heruntergeregelt oder ganz abgestellt wird, oder wenn das Festbett Schattenräume hat, in denen die Strömung gering ist, kann des dort zur Ausbildung deutlich wärmerer Zonen kommen, die nicht im thermischen Gleichgewicht mit ihrer Umgebung sind – sogenannte Hotspots.
Wie der Thermal Runaway vor sich geht
Eine Selbsterwärmung bis zum thermischen Durchgehen benötigt immer eine chemische Reaktion, die im Adsorbat vor sich geht. Zwar erzeugt die reine Adsorption auch Wärme, vor allem bei hohen Adsorptivkonzentrationen im Rohgas, jedoch kann die Adsorptionsenthalpie nur einen ersten Temperatursprung erzeugen, sie kann nicht fortwährend Wärme liefern.
Die Reaktion ist meistens eine Oxidation. Weil die meisten Adsorber mit Luft durchströmt werden, ist Sauerstoff vorhanden. Eine Oxidationsreaktion, die irgendwo spontan beginnt [2], kann sich zu einem Hotspot auswachsen.
Zwei Zustände fördern das Phänomen besonders:
(a) Es ist viel Adsorbat auf dem Adsorbens vorhanden, sei es, weil der Adsorber (noch) nicht regeneriert wurde oder weil die Regeneration nicht richtig funktioniert und sich somit teilweise zersetzte Rückstände angehäuft haben („Fouling“).
(b) Der Gasstrom durch den Adsorber ist gering oder wurde ganz abgestellt.
Wenn es an einem Punkt eines solchen Adsorbers zu einer Oxidation kommt, erzeugt diese zunächst nur wenige Grad Temperaturerhöhung, diese Wärme wird aber zusammengehalten und beschleunigt die Oxidation.
Ab einer bestimmten Temperatur wird der diffusive Antransport des Sauerstoffs zum begrenzenden Faktor, und die Reaktion geht mit der jetzt erreichten Geschwindigkeit weiter, mit der neuer Sauerstoff herandiffundiert. Dies kann ziemlich lange so weitergehen – bei den typischen Adsorbergrößen für mehrere tausend m³/h tagelang – bis dann der Montag da ist und der Betrieb wieder angefahren wird.
Nun sind zwei Ausgänge möglich:
(a) Der größere Luftstrom genügt, um die Wärme aus dem Hotspot abzuführen, wodurch die Oxidationsreaktion zum erliegen kommt: Sie wird sozusagen „ausgeblasen“.
(b) Die Kühlung durch den Luftstrom genügt nicht, um die Reaktion zu unterdrücken, dafür bringt die Frischluft reichlich neuen Sauerstoff ins Geschehen, und nun kann die Oxidation sich ausbreiten und den ganzen Adsorber erfassen: Der Thermal Runaway ist da und kann nicht nur bei Aktivkohle, sondern auch bei Zeolith Temperaturen erreichen, die den Stahl anlaufen lassen. Bei Aktivkohle ist der potenzielle Schaden, bedingt durch die größere Brennmasse, natürlich noch größer.
[1] Es ist sehr schwer, die Wärmeleitfähigkeit von Zeolithpellets zu messen, weil man zunächst festlegen muss, was man misst: Die enthaltenen Adsorbate, vor allem Wasser, die bis zu 25% Bindemittel, die Kristallitgrößen des eigentlichen Zeolithen, seine Art – 4A, Na-Y oder was auch immer – und andere Einflussfaktoren führen zu recht unterschiedlichen Messergebnissen. Ein typischer Wert, der angegeben wird, liegt bei 0,15 W/mK (zum Vergleich Luft bei 0 °C, 1 bar: 0,024 W/mK). Die Werte können unter anderen Bedingungen (z. B. für Monolithe, die allerdings eine absolute Laborkuriosität sind) jedoch bis über 3 W/mK steigen. Literatur z. b. Liu et al., oder Shimonosono et al.
[2] Verschiedene Kohlen erwärmen sich bei Luftzutritt von selbst, siehe z. B. Yuan, L. & Smith, A. C. The effect of ventilation on spontaneous heating of coal. Auf Zeolith (der bis zu 30% oder mehr organisches Adsorbat enthalten kann) adsorbierte Moleküle sind aktiviert und somit reaktionsfreudiger, und Zeolihe haben eine, von ihrem Typ abhängige, katalytische Aktivität.
Schreibe einen Kommentar